🐞 THREAD 🐞
Aujourd'hui, c'est COVID-19 au programme !
Je souhaite vous présenter une cible médicamenteuse dont on n'a, à ma connaissance, jamais trop parlé sur le Twitter médical francophone (ce qui nous permettra au passage de revenir en détails sur le virus).
⬇️⬇️⬇️⬇️⬇️
Aujourd'hui, c'est COVID-19 au programme !
Je souhaite vous présenter une cible médicamenteuse dont on n'a, à ma connaissance, jamais trop parlé sur le Twitter médical francophone (ce qui nous permettra au passage de revenir en détails sur le virus).
⬇️⬇️⬇️⬇️⬇️

Dans un souci de ne pas prolonger le suspense, je peux d'ores et déjà vous faire savoir que la fameuse cible n'appartient pas à nos cellules, mais à SARS-CoV-2 lui-même : il s'agit en effet d'une protéase, qui œuvre directement, mais aussi indirectement à la réplication du virus
dans nos cellules.
Cela dit, si j'étais à votre place, j'aimerais bien qu'on me fournisse un minimum de contexte au préalable - sans quoi, il me manquerait un morceau de l'histoire.
Quelles étapes précèdent et engendrent l'apparition de cette protéase dans le cycle infectieux ?
Cela dit, si j'étais à votre place, j'aimerais bien qu'on me fournisse un minimum de contexte au préalable - sans quoi, il me manquerait un morceau de l'histoire.
Quelles étapes précèdent et engendrent l'apparition de cette protéase dans le cycle infectieux ?

Afin de répondre à cette première question, je vous propose donc qu'on étudie ensemble le cycle de réplication du virus ; puis, une fois arrivés au stade où la protéase intervient, on s'épanchera sur son rôle, ou plutôt, ses rôles, afin d'évaluer quels bénéfices on pourrait tirer
de son inhibition.
Vous êtes prêts ? Alors c'est parti !
Pas d'inquiétude, on va attaquer en douceur...
Vous êtes prêts ? Alors c'est parti !
Pas d'inquiétude, on va attaquer en douceur...
Voici donc le vilain SARS-CoV-2, le virus responsable du COVID-19.
Comme on peut l'observer, des dizaines de spicules (les fameuses spikes), ou glycoprotéines de pointe, forment une couronne autour de sa membrane : c'est pour ça qu'on lui a donné le nom de coronavirus.
Comme on peut l'observer, des dizaines de spicules (les fameuses spikes), ou glycoprotéines de pointe, forment une couronne autour de sa membrane : c'est pour ça qu'on lui a donné le nom de coronavirus.
Ces spicules se composent de deux sous-unités, S1 et S2, dont les rôles sont à la fois complémentaires et indispensables pour le virus : sans l'ouvrage de l'une ou de l'autre, SARS-CoV-2 ne peut pas infecter nos cellules.
Crédit : Lorenzo Casalino, Univ. California, San Diego.
Crédit : Lorenzo Casalino, Univ. California, San Diego.

La première des deux à s'illustrer, c'est la sous-unité S1 : par son intermédiaire, la spicule va établir une interaction avec l'enzyme ACE2 * présente à la surface de la cellule hôte, assurant ainsi la première étape du cycle infectieux qu'on appelle l'attachement. 



Attention cependant !
Si on veut être plus précis, il convient de dire que ce n'est pas tout à fait S1 qui entre en contact direct avec ACE2, mais plutôt son RBD, ici en rouge sur notre spicule.
RBD = receptor binding domain (domaine de liaison au récepteur).
Si on veut être plus précis, il convient de dire que ce n'est pas tout à fait S1 qui entre en contact direct avec ACE2, mais plutôt son RBD, ici en rouge sur notre spicule.
RBD = receptor binding domain (domaine de liaison au récepteur).

Comme on peut le voir, il y a trois RBD par spicule, tous inclus dans la sous-unité S1.
Quand ils sont rétractés (RBD 'down'), la spicule se trouve en conformation dite fermée.
Quand ils sont rétractés (RBD 'down'), la spicule se trouve en conformation dite fermée.

À l'inverse, quand l'un ou plusieurs d'entre eux se déploient (RBD 'up'), elle passe en conformation ouverte. 

Sachez que pour une interaction efficace avec ACE2, la spicule a besoin d'être en conformation ouverte, c'est-à-dire avec au moins un RBD 'up'.
Mais si les trois sont déployés, ça permet à la spicule d'établir une liaison avec trois récepteurs ACE2 en même temps.
Mais si les trois sont déployés, ça permet à la spicule d'établir une liaison avec trois récepteurs ACE2 en même temps.

Attention (bis) !
Si on veut être encore plus précis, on dira que ce n'est pas exactement le RBD qui se lie au récepteur ACE2, mais le RBM qu'on trouve tout au bout.
RBM = receptor binding motif (motif de liaison au récepteur).
Crédit : Mohd Gazzali A, et al. Molecules. 2020 Sep
Si on veut être encore plus précis, on dira que ce n'est pas exactement le RBD qui se lie au récepteur ACE2, mais le RBM qu'on trouve tout au bout.
RBM = receptor binding motif (motif de liaison au récepteur).
Crédit : Mohd Gazzali A, et al. Molecules. 2020 Sep

Bref !
Une fois que la spicule a interagi avec ACE2 par le biais de S1, mais plus précisément par le biais du RBD, et plus précisément encore par le biais du RBM (c'est compliqué tout ça ! 😅), il s'agit maintenant pour le virus de larguer son matériel génétique (son ARN)
Une fois que la spicule a interagi avec ACE2 par le biais de S1, mais plus précisément par le biais du RBD, et plus précisément encore par le biais du RBM (c'est compliqué tout ça ! 😅), il s'agit maintenant pour le virus de larguer son matériel génétique (son ARN)
dans le cytoplasme de notre cellule afin de lancer la réplication proprement dite.
Petit problème : SARS-CoV-2 ne peut pas transférer son ARN tant qu'il n'a pas fait fusionner son enveloppe avec la membrane de la cellule.
Petit problème : SARS-CoV-2 ne peut pas transférer son ARN tant qu'il n'a pas fait fusionner son enveloppe avec la membrane de la cellule.
Or, cette fusion dépend de l'activité du peptide de fusion (FP) qui, inclus dans la sous-unité S2, n'est pas disponible dans l'état actuel, car S1 fait en quelque sorte obstruction. 

S1, qui a déjà accompli sa mission, est devenue un fardeau. Le virus doit maintenant s'en débarrasser.
Comment ? En faisant cliver sa spicule par une enzyme qui nous appartient - et qui va donc un peu nous trahir.
Comment ? En faisant cliver sa spicule par une enzyme qui nous appartient - et qui va donc un peu nous trahir.
Souvent, ce rôle de la traitresse échoit à TMPRSS2, elle aussi présente à la surface de la cellule.
Dans ce cas, on dit que le virus a emprunté la voie directe.
Dans ce cas, on dit que le virus a emprunté la voie directe.

Cependant, il existe une voie alternative, qu'on appelle la voie endosomale.
Dans ce cas de figure, le virus pénètre à l'intérieur de la cellule hôte, puis dans l'endosome, il fait cliver sa spicule par une autre enzyme protéolytique du nom de cathepsine-L.
Dans ce cas de figure, le virus pénètre à l'intérieur de la cellule hôte, puis dans l'endosome, il fait cliver sa spicule par une autre enzyme protéolytique du nom de cathepsine-L.

À noter que l'hydroxychloroquine est efficace in vitro pour bloquer la voie endosomale, mais pas la voie directe.
Pour plus d'infos, lire ce thread :
Pour plus d'infos, lire ce thread :
https://twitter.com/Locuste_/status/1431929954304987136
Comme on le doit, donc, ce virus a donc deux possibilités pour faire cliver sa spicule - et ainsi la décharger de S1.
« Mais quelle est sa voie préférentielle ? Son degré d'affinité pour l'une et l'autre ? », allez-vous me demander.
« Mais quelle est sa voie préférentielle ? Son degré d'affinité pour l'une et l'autre ? », allez-vous me demander.
Eh bien en fait ça dépend, car la vérité d'un variant n'est pas toujours celle des autres !
nature.com/articles/s4158…
nature.com/articles/s4158…
Toujours est-il qu'après la disparition de S1, la fusion peut commencer !
D'abord, la spicule (ou du moins ce qu'il en reste, c'est-à-dire S2) va subir un nouveau changement de conformation pour que le peptide de fusion, enfin libéré, puisse s'ancrer dans la membrane cellulaire.
D'abord, la spicule (ou du moins ce qu'il en reste, c'est-à-dire S2) va subir un nouveau changement de conformation pour que le peptide de fusion, enfin libéré, puisse s'ancrer dans la membrane cellulaire.
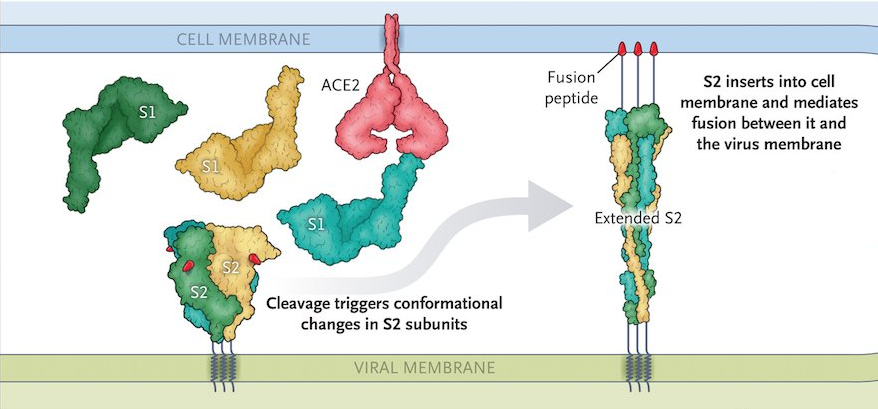
Puis, dans un second temps, S2 va se replier sur elle-même de sorte à rapprocher la membrane cellulaire de l'enveloppe virale ; ce faisant, elle finira par déclencher leur fusion (comme vous l'aurez compris, c'est une illustration de la voie directe, ici). 

Et donc, suite à la fusion, le virus peut enfin larguer son ARN dans le cytoplasme de notre pauvre cellule. 

Alors, je ne vous l'ai pas encore précisé, mais l'ARN monocaténaire (c'est-à-dire, avec un seul brin) du virus SARS-CoV-2 est de polarité positive.
Cela veut dire qu'une fois dans le cytoplasme, il peut être immédiatement traduit - ou converti, si ça vous parle davantage -
Cela veut dire qu'une fois dans le cytoplasme, il peut être immédiatement traduit - ou converti, si ça vous parle davantage -
en protéines.
Exactement comme un ARN messager.
Exactement comme un ARN messager.
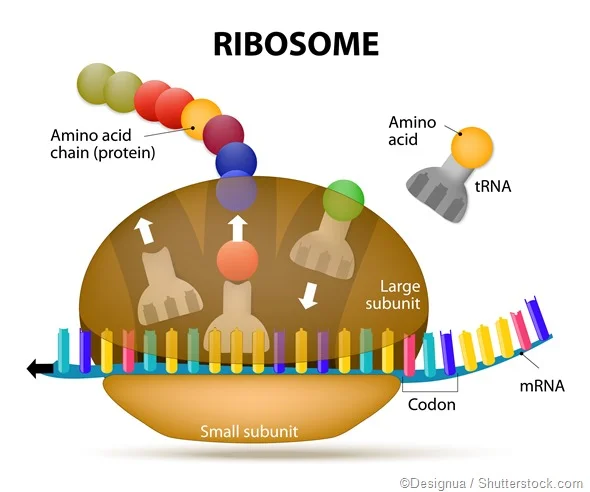
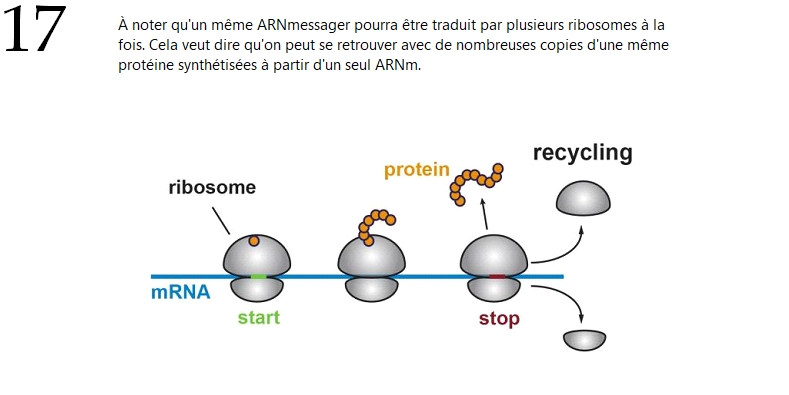
Comment est assurée la traduction ?
Par l'intermédiaire d'organites qu'on appelle les ribosomes. Cela se fait en plusieurs étapes.
1⃣ L'ARN viral est associé au ribosome.
2⃣Le ribosome lit les instructions portées par l'ARN, et, à partir de ces dernières, synthétise
Par l'intermédiaire d'organites qu'on appelle les ribosomes. Cela se fait en plusieurs étapes.
1⃣ L'ARN viral est associé au ribosome.
2⃣Le ribosome lit les instructions portées par l'ARN, et, à partir de ces dernières, synthétise
En temps normal, les ribosomes sont dévoués à la traduction des ARNm cellulaires.
Mais dans le cas présent, SARS-CoV-2, qui n'en possède pas et a donc besoin des nôtres pour se répliquer, SARS-CoV-2 va les détourner à son profit pour leur faire traduire son propre ARN.
Mais dans le cas présent, SARS-CoV-2, qui n'en possède pas et a donc besoin des nôtres pour se répliquer, SARS-CoV-2 va les détourner à son profit pour leur faire traduire son propre ARN.
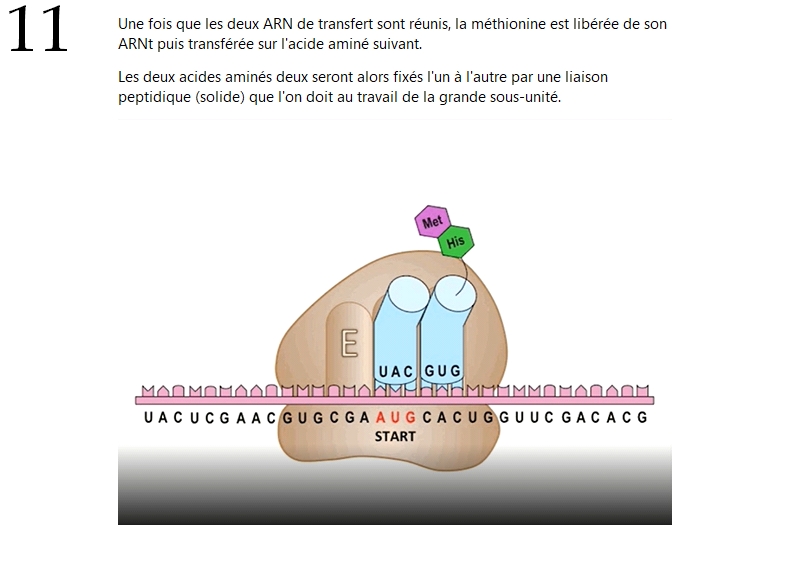
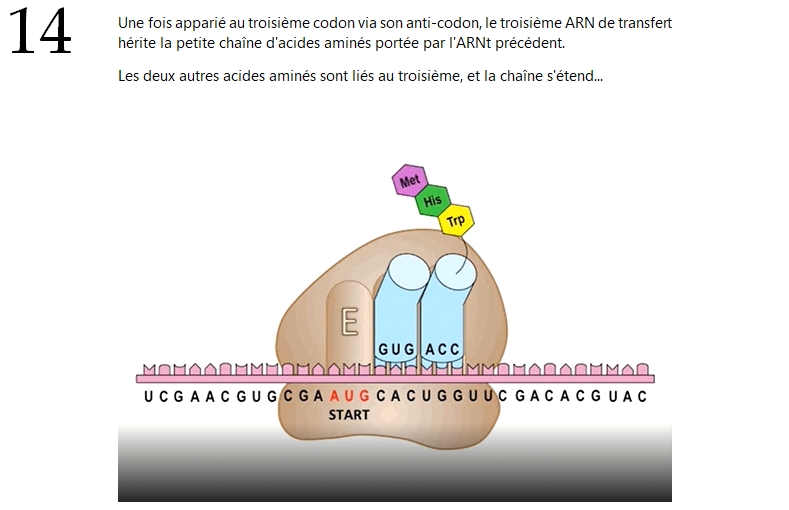
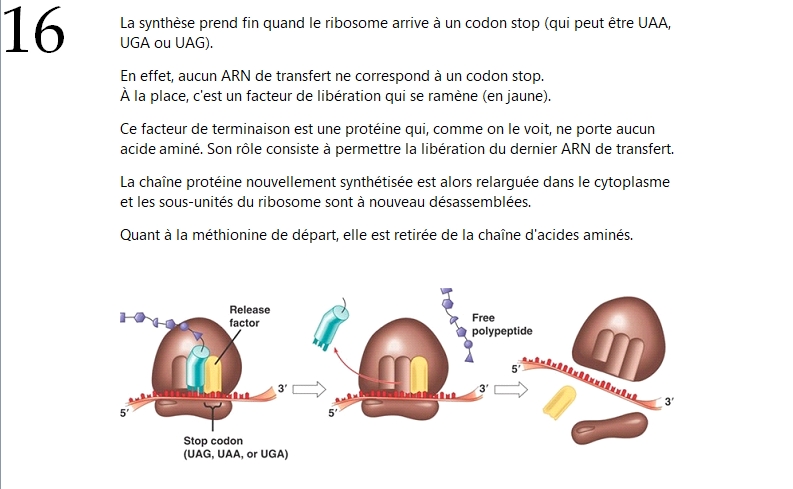
Alors maintenant, pour ceux que ça intéresse (en partant du principe qu'il y en a au moins quelques-uns), je vais prendre le temps de résumer en quelques tweets les différentes étapes de la traduction d'un ARNm par un ribosome.
Si au contraire le sujet ne vous branche pas trop, vous pourrez toujours sauter ce passage : il n'est pas absolument nécessaire à la bonne compréhension de ce qui va suivre.
Revenons-en à SARS-CoV-2.
Il faut savoir qu'après le largage de son génome dans le cytoplasme, les ribosomes ne vont pas traduire l'ARN viral tout entier, mais seulement le gène OR1Fab, qui en constitue les deux premiers tiers.
Il faut savoir qu'après le largage de son génome dans le cytoplasme, les ribosomes ne vont pas traduire l'ARN viral tout entier, mais seulement le gène OR1Fab, qui en constitue les deux premiers tiers.

Cette traduction aboutit à la naissance de deux polyprotéines :
🐞 La première, pp1a, est une chaîne de 11 protéines (ouais, ici on ne voit pas la numéro 11 qui n'est qu'un petit peptide de seulement quelques acides aminés) solidement liées les unes aux autres
🐞 La première, pp1a, est une chaîne de 11 protéines (ouais, ici on ne voit pas la numéro 11 qui n'est qu'un petit peptide de seulement quelques acides aminés) solidement liées les unes aux autres
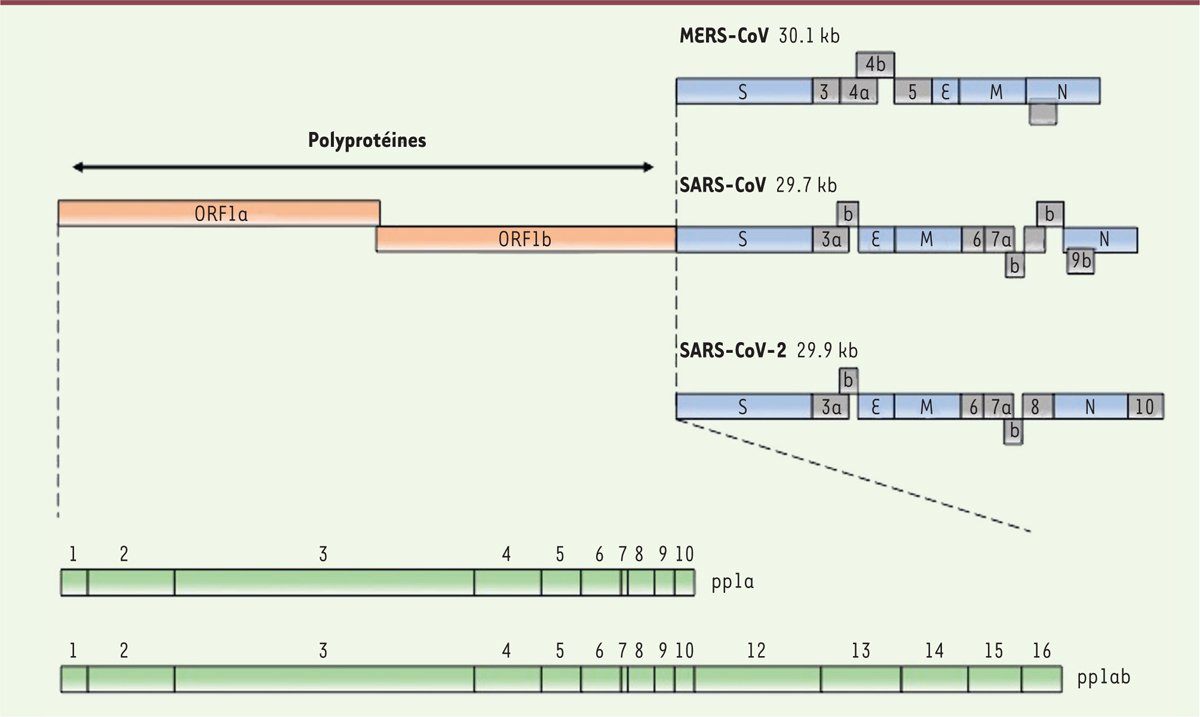
🐞 Quant à la seconde, pp1ab, elle est une réplique de la chaîne pp1a dans le même ordre, mais au bout, viennent s'ajouter 5 autres protéines : numéro 12, numéro 13, numéro 14, numéro 15 et numéro 16. 

En traduisant le gène ORF1ab, les ribosomes ont donc fabriqué pas moins de 16 protéines différentes.
Ce sont des protéines dites non structurales (abréviation : NSP pour non structural proteins) dans la mesure où elles ne seront pas incorporées au virus prochainement fabriqué.
Ce sont des protéines dites non structurales (abréviation : NSP pour non structural proteins) dans la mesure où elles ne seront pas incorporées au virus prochainement fabriqué.
En effet, tout leur rôle consiste à œuvrer pour la réplication de SARS-CoV-2 à l'intérieur de notre cellule.
Ce sont des ouvrières de la réplication virale.
Ce sont des ouvrières de la réplication virale.
Certaines de ces protéines, en formant le complexe replicase-transcriptase, vont participer directement à la réplication de l'ARN du virus. 

Pour d'autres, il s'agit plutôt de favoriser cette réplication, ou tout du moins faire en sorte qu'elle se déroule dans les meilleures conditions possibles.
Ce qui passe par la neutralisation de certains soldats de l'immunité innée - laquelle constitue la première ligne de défense de notre organisme contre le virus...
Seulement, il faut rappeler que suite à leur fabrication par les ribosomes, ces protéines non structurales sont liées les unes aux autres ; ainsi entravées, elles ne peuvent rien faire.
Pour les rendre fonctionnelles, il va donc falloir les désassembler dans un premier temps, en coupant leurs jonctions (et on appelle ça le traitement des polyprotéines virales).
Cette fois-ci, l'opération ne va pas s'effectuer par l'intermédiaire d'un élément du soi, mais par celle de deux protéases virales, PLpro et Mpro, situées respectivement dans NSP3 et NSP5. 
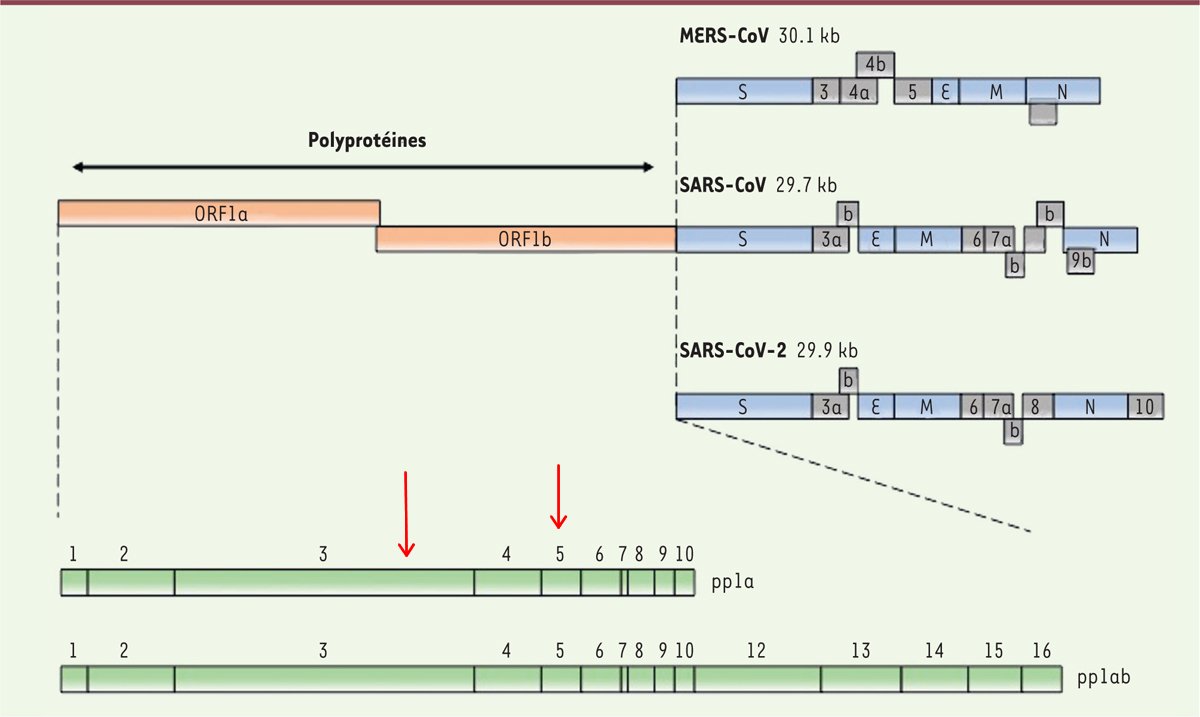
NSP3 et NSP5 seront d'abord libérées par auto-clivage, puis viendront ensuite détacher leurs camarades, NSP3 s'occupant de NSP1 et NSP2, tandis que NSP5 se chargera de toutes les autres. 

C'est ainsi que les NSP libres, matures et fonctionnelles pourront enfin jouer leurs rôles.
Certaines, comme je l'ai dit, vont se réassembler pour former le complexe replicase-transcriptase, pendant que d'autres vont mener une guerre sans merci à la réponse immunitaire de l'hôte.
Certaines, comme je l'ai dit, vont se réassembler pour former le complexe replicase-transcriptase, pendant que d'autres vont mener une guerre sans merci à la réponse immunitaire de l'hôte.
Ce sera tout pour aujourd'hui concernant la réplication du virus - du moins, dans sa globalité.
Si la curiosité vous anime, je vous propose de jeter un œil à mon thread sur le Molnupiravir (un candidat-traitement qui paraissait prometteur, mais qui a fait pschitt), où je résume les étapes suivantes à grands traits.
https://twitter.com/Locuste_/status/1457314954885926915
Mais pour l'heure, nous allons (enfin) nous intéresser à notre fameuse cible thérapeutique, dont il ne vous aura sûrement pas échappé que je viens de l'introduire.
Souvenez-vous : je vous avais bien parlé d'une protéase virale au début de mon récit !
Souvenez-vous : je vous avais bien parlé d'une protéase virale au début de mon récit !
Sauf que le clivage de la polyprotéine fait intervenir, comme nous l'avons vu, deux protéases et non pas une seule.
Laquelle va nous occuper aujourd'hui, selon vous ?
Laquelle va nous occuper aujourd'hui, selon vous ?
Si votre choix se porte sur Mpro... c'est la mauvaise réponse !
En effet, MPro est déjà la cible médicamenteuse du Nirmatrelvir PF-07321332, que l'on trouve dans le Paxlovid.
Pour en savoir plus, rendez-vous ici :
En effet, MPro est déjà la cible médicamenteuse du Nirmatrelvir PF-07321332, que l'on trouve dans le Paxlovid.
Pour en savoir plus, rendez-vous ici :
https://twitter.com/Locuste_/status/1464920687726977032
Mes plus sincères félicitations si vous avez au contraire pensé à PLPro.
C'est bien d'elle qu'on va parler aujourd'hui.
C'est bien d'elle qu'on va parler aujourd'hui.

Alors déjà, si on veut partir sur de bonnes bases, il faut se faire une idée plus précise de ce qu'est PLPro.
Car malheureusement, dans beaucoup d'études que vous lirez, on a une tendance pour le moins fâcheuse à assimiler PLPro et NSP3, comme si les deux étaient synonymes.
Car malheureusement, dans beaucoup d'études que vous lirez, on a une tendance pour le moins fâcheuse à assimiler PLPro et NSP3, comme si les deux étaient synonymes.

Mais en réalité, PLpro n'est qu'une partie, un domaine au sein de la protéine multidomaines que représente NSP3 (et qui, par ailleurs, se veut la plus grande des protéines non-structurelles du virus). 

Maintenant, voyons un peu à quoi ressemble PLPro, sa structure.
Comme on peut l'observer, elle se compose de deux domaines distincts : il y a tout d'abord le domaine Ubl (en haut à droite), puis ce qu'on appelle le domaine catalytique,
Comme on peut l'observer, elle se compose de deux domaines distincts : il y a tout d'abord le domaine Ubl (en haut à droite), puis ce qu'on appelle le domaine catalytique,

lui-même divisé en trois sous-domaines que sont le pouce, la paume et les doigts (je crois que ça demande un effort d'imagination, pour le coup). 

Quant au site actif (c'est-à-dire la région précise de PLpro qui interagit avec la polyprotéine virale), il se situe dans l'interface entre le pouce et la paume.
On y trouve notamment trois acides aminés : Cys111, His272 et Asp286, qui constituent
On y trouve notamment trois acides aminés : Cys111, His272 et Asp286, qui constituent

ce qu'on appelle la triade catalytique - les lames de PLpro, en quelque sorte.
Maintenant qu'on est un peu familiarisés, ne serait-ce que visuellement, avec PLpro, passons à l'étude de ses fonctions.
Maintenant qu'on est un peu familiarisés, ne serait-ce que visuellement, avec PLpro, passons à l'étude de ses fonctions.
Comme on le sait déjà, c'est une protéase sine qua non de la réplication virale en ce qu'elle permet le traitement
des polyprotéines pp1a et pp1ab, et de ce fait la libération puis la maturation des protéines non-structurales (NSP) dont certaines vont ensuite se réassembler
des polyprotéines pp1a et pp1ab, et de ce fait la libération puis la maturation des protéines non-structurales (NSP) dont certaines vont ensuite se réassembler
pour former le complexe réplicase-transcriptase indispensable à la suite des évènements (voir mon thread sur le Molnupiravir).
Aussi, PLpro, ou tout du moins NSP3, participe à réarranger certains composants de la cellule (la membrane du réticulum endoplasmique) au profit du
Aussi, PLpro, ou tout du moins NSP3, participe à réarranger certains composants de la cellule (la membrane du réticulum endoplasmique) au profit du
virus et de sa réplication.
Cependant, en plus d'être un chaînon essentiel de la réplication à travers ses rôles susmentionnées, PLPro la favorise également d'une manière indirecte, en régulant la réponse immunitaire de l'hôte à la baisse.
Cependant, en plus d'être un chaînon essentiel de la réplication à travers ses rôles susmentionnées, PLPro la favorise également d'une manière indirecte, en régulant la réponse immunitaire de l'hôte à la baisse.
Un tour de force qu'elle est en mesure de réaliser grâce à ses fonctions de... déubiquitination et de désISGylation.
J'imagine bien ce qu'on peut ressentir à l'évocation de ces mots.
« Déubiquitination... DésISGylation... Mais qu'est-ce que ça peut bien vouloir dire ??? »
Pour bien comprendre de quoi il s'agit, il vous faut connaître certaines bases.
On va donc reparler un peu des protéines !
« Déubiquitination... DésISGylation... Mais qu'est-ce que ça peut bien vouloir dire ??? »
Pour bien comprendre de quoi il s'agit, il vous faut connaître certaines bases.
On va donc reparler un peu des protéines !

Comme nous l'avons vu, les protéines sont fabriquées par des ribosomes, mais il faut savoir qu'à ce stade, le travail n'est encore pas terminé.
En effet, les protéines peuvent, à tout moment de leur de cycle de vie, et parfois même juste après la traduction, les protéines peuvent être amenées à subir ce que l'on appelle des modifications post-traductionnelles.
Les modifications post-traductionnelles (MPTs) sont des modifications biologiques ou chimiques, réversibles ou irréversibles, qui permettent de réguler l'activité (activation, inhibition...), la localisation ou encore les interactions (avec les autres molécules cellulaires)
de la protéine ainsi modifiée.
En général, ce processus fait intervenir des enzymes tierces.
En général, ce processus fait intervenir des enzymes tierces.
De très nombreux types de MPTs ont déjà été recensés : en fait, il en existe tellement qu'il n'est pas question pour moi de les énumérer ici.
Je vais toutefois m'accorder une seconde pour vous en faire connaître une qui concerne directement la partie de SARS-CoV-2 la plus connue par le grand public, à savoir la spicule.
Vous avez dû remarquer dans certains schémas, et même au début de ce thread, qu'on appelle souvent cette spicule glycoprotéine de pointe, n'est-ce pas ?
Si oui, vous avez dû vous demander : « Mais pourquoi glyco ? On ne me l'a jamais expliqué. »
Si oui, vous avez dû vous demander : « Mais pourquoi glyco ? On ne me l'a jamais expliqué. »
Eh bien, c'est tout simplement car les spikes observées à la surface du virus sont le résultat d'un type très courant de MPT qui répond au nom de glycosylation.
Médiée par des enzymes de l'hôte, cette glycosylation consiste en l'attachement de glycanes (des molécules de sucre, pour faire simple) sur notre spicule.
Évidemment, une telle fixation est possible parce que la protéine de pointe arbore des sites auxquels les glycanes peuvent se lier - cependant, au gré des mutations virales, certaines sites peuvent disparaître, et d'autres apparaître. 

Cette glycosylation confère à la spike une espèce de manteau qui la camoufle en partie, recouvrant à peu près 40% de sa surface.
Cela a pour effet de diminuer sa reconnaissance par l'hôte, mais aussi de réduire l'exposition de certaines régions à nos anticorps neutralisants.
Cela a pour effet de diminuer sa reconnaissance par l'hôte, mais aussi de réduire l'exposition de certaines régions à nos anticorps neutralisants.
Mais dites-vous bien que dans tout ça, on peut encore s'estimer heureux !
En effet, si la spicule de SARS-CoV-2 est fortement glycosylée, sachez que celle de SARS-CoV et MERS-CoV, les deux autres coronavirus hautement pathogènes, ont une densité de glycosylation bien supérieure.
En effet, si la spicule de SARS-CoV-2 est fortement glycosylée, sachez que celle de SARS-CoV et MERS-CoV, les deux autres coronavirus hautement pathogènes, ont une densité de glycosylation bien supérieure.
D'autre part, cette glycosylation accroit la flexibilité de la spicule, son niveau d'affinité (et donc la qualité de son interaction) avec ACE2, et, par conséquent, l'infectiosité du virus.
pnas.org/doi/10.1073/pn…
pnas.org/doi/10.1073/pn…
Cette glycosylation, on le voit, apporte de nombreux avantages à notre spicule.
Pourtant, dès qu'il s'agit de représenter cette dernière (y compris dans les nombreuses études publiées par de grandes revues à comité de lecture), la plupart du temps, on nous la fait voir
Pourtant, dès qu'il s'agit de représenter cette dernière (y compris dans les nombreuses études publiées par de grandes revues à comité de lecture), la plupart du temps, on nous la fait voir
dans son état non-glycosylé, tout en l'appelant glycoprotéine par ailleurs.
Sans autre explication disponible, le lecteur est évidemment jeté dans une épaisse confusion.
Sans autre explication disponible, le lecteur est évidemment jeté dans une épaisse confusion.

En vérité, une représentation déjà un peu plus juste de notre glycoprotéine de pointe pourrait ressembler à ce qui se trouve sur la droite...
À gauche, elle est telle qu'on la voit partout, non-glycosylée.
À gauche, elle est telle qu'on la voit partout, non-glycosylée.

Au passage, les protéines E et M du virus possèdent également des sites pour être glycosylées, mais ça me paraît moins intéressant (et puis bon, ça n'a pas été aussi étudié que la glycosylation de la spicule).
Bref !
Bref !
Nous allons donc enchaîner tout de suite avec le type de MPT le plus important de mon récit : l'ubiquitination.
Pour rendre les choses simples, je vais essayer d'aller droit au but !
Pour rendre les choses simples, je vais essayer d'aller droit au but !
Qu'est-ce que l'ubiquitination d'une protéine ? L'attachement réversible de l'ubiquitine sur ladite protéine.
Qu'est-ce que l'ubiquitine ? Une protéine elle aussi, mais petite (de 76 acides aminés).
Comme vous l'aurez peut-être deviné, elle doit son nom à sa présence ubiquitaire
Qu'est-ce que l'ubiquitine ? Une protéine elle aussi, mais petite (de 76 acides aminés).
Comme vous l'aurez peut-être deviné, elle doit son nom à sa présence ubiquitaire
dans les cellules eucaryotes (c'est-à-dire, les cellules qui possèdent un noyau).
Voici la structure de l'ubiquitine.
L'ubiquitination se fait par l'établissement d'une liaison entre un résidu de glycine présent à l'extrémité C-terminale de l'ubiquitine (le Gly76 que vous voyez tout en bas) et un acide aminé de la protéine cible,
L'ubiquitination se fait par l'établissement d'une liaison entre un résidu de glycine présent à l'extrémité C-terminale de l'ubiquitine (le Gly76 que vous voyez tout en bas) et un acide aminé de la protéine cible,

bien que d'autres acides aminés comme la thréonine, la cystéine ou encore la sérine puissent également se lier à l'ubiquitine.
sciencedirect.com/science/articl…
sciencedirect.com/science/articl…
Cependant, l'ubiquitination d'une protéine requiert plusieurs étapes ; rappelez-vous ce que j'ai dit tout à l'heure : la plupart du temps, les modifications post-traductionnelles nécessitent le concours d'enzymes tierces.
Et dans le cadre de l'ubiquitination, ce n'est pas une, ni deux, mais trois enzymes différentes qui interviennent successivement dans le processus : les E1, les E2 et les E3.
Ensemble, elles permettent l'activation puis le transfert de l'ubiquitine sur la protéine cible, qu'on appelle également le substrat.
À noter qu'il existe différents types d'E1, d'E2 et d'E3.
À noter qu'il existe différents types d'E1, d'E2 et d'E3.
Les E1 se comptent sur les doigts d'une main, tandis qu'on a recensé des dizaines d'E2.
Quant aux E3, on en connaît aujourd'hui des centaines (leur grande diversité vient probablement de ce qu'elles sont impliquées dans la reconnaissance spécifique de la protéine cible), que
Quant aux E3, on en connaît aujourd'hui des centaines (leur grande diversité vient probablement de ce qu'elles sont impliquées dans la reconnaissance spécifique de la protéine cible), que
l'on peut diviser en deux grandes classes : les RING et les HECT.
Les HECT, comme on le voit, prennent en charge l'ubiquitine et la transportent elles-mêmes jusqu'au substrat, tandis qu'avec les RING, l'ubiquitine passe directement de l'E2 au substrat.
Les HECT, comme on le voit, prennent en charge l'ubiquitine et la transportent elles-mêmes jusqu'au substrat, tandis qu'avec les RING, l'ubiquitine passe directement de l'E2 au substrat.

Bref !
Attendu que j'ai souligné le rôle majeur des E3 dans la reconnaissance du substrat, sachez que leur côté, les E2 détermineraient plutôt le choix... du type d'ubiquitination apportée à la protéine cible.
nature.com/articles/nrm27…
Attendu que j'ai souligné le rôle majeur des E3 dans la reconnaissance du substrat, sachez que leur côté, les E2 détermineraient plutôt le choix... du type d'ubiquitination apportée à la protéine cible.
nature.com/articles/nrm27…
Non, vous n'avez pas mal lu : l'ubiquitination elle-même se divise en de nombreux types.
Et chacun d'entre eux exerce une influence bien particulière sur le destin de la protéine cible.
(Je sais qu'il y a beaucoup de choses à retenir d'un seul coup. 😭)
Et chacun d'entre eux exerce une influence bien particulière sur le destin de la protéine cible.
(Je sais qu'il y a beaucoup de choses à retenir d'un seul coup. 😭)
Mais voyons ensemble les diverses possibilités.
Lorsqu'une ubiquitine se fixe au substrat (par le biais d'une liaison avec une lysine de la protéine cible, comme nous l'avons vu), on parle de monoubiquitination.
nature.com/articles/s4142…
Lorsqu'une ubiquitine se fixe au substrat (par le biais d'une liaison avec une lysine de la protéine cible, comme nous l'avons vu), on parle de monoubiquitination.
nature.com/articles/s4142…
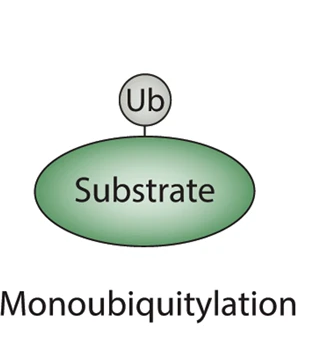
Mais parfois, plusieurs ubiquitines entrent en scène.
Quand ces dernières s'attachent au même substrat, chacune via des sites (je veux dire des résidus lysine) différents, il s'agit alors d'une multi-monoubiquitination.
Quand ces dernières s'attachent au même substrat, chacune via des sites (je veux dire des résidus lysine) différents, il s'agit alors d'une multi-monoubiquitination.

Enfin, dans un troisième cas de figure qu'on appelle la polyubiquitination, les ubiquitines impliquées vont former une chaîne reliée à une seule et même lysine du substrat. 

En effet, les ubiquitines peuvent également s'attacher les unes aux autres.
Souvenez-vous que cette protéine de 76 acides aminés arbore pas moins de sept résidus lysine à sa surface, soit autant de sites accepteurs potentiels pour une autre ubiquitine.
Souvenez-vous que cette protéine de 76 acides aminés arbore pas moins de sept résidus lysine à sa surface, soit autant de sites accepteurs potentiels pour une autre ubiquitine.

En plus de ces sept lysines, le résidu méthionine à l'extrémité N terminale peut également recevoir une ubiquitine.
Cela donne en tout huit sites disponibles : K6, K11, K29, K27, K33, K48, K63 et M1.
Cela donne en tout huit sites disponibles : K6, K11, K29, K27, K33, K48, K63 et M1.
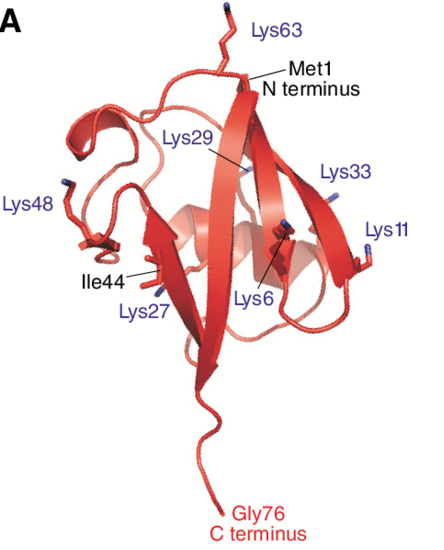
Parfois, toutes les ubiquitines de la chaîne seront attachées les unes aux autres par le même site. Nous aurons donc une chaîne homogène (ou homotypique).
Ici, les ubiquitines sont toutes reliées, à gauche par leur lysine 48, à droite par leur lysine 64.
Ici, les ubiquitines sont toutes reliées, à gauche par leur lysine 48, à droite par leur lysine 64.

À l'inverse, si elles ne sont pas toutes reliées par le même résidu lysine, elles forment une chaîne mixte (ou hétérotypique), voire une chaîne branchée (vaut mieux ça que d'être démodé, après tout). 

Là encore, chaque type de chaîne aura une action différente sur la protéine cible.
Alors bien sûr, j'aimerais vous décrire précisément à quoi correspond chaque type d'ubiquitination, mais le fait est qu'il reste encore pas mal de doutes sur les fonctions des unes et des autres,
Alors bien sûr, j'aimerais vous décrire précisément à quoi correspond chaque type d'ubiquitination, mais le fait est qu'il reste encore pas mal de doutes sur les fonctions des unes et des autres,
et malgré un certain nombre de pistes tout à fait crédibles, je n'ai pas envie d'improviser sur ce point. 

Quoi qu'il en soit, parmi toutes les conséquences de l'ubiquitination d'une protéine, la plus connue est certainement la dégradation protéasomique.
⬇️⬇️⬇️⬇️⬇️
⬇️⬇️⬇️⬇️⬇️
Il se trouve que lorsqu'une protéine est endommagée, mal repliée, ou, si vous préférez, anormale, nos cellules disposent des outils nécessaires pour les éliminer.
Notamment, elles peuvent s'appuyer sur un complexe protéique qu'on appelle le protéasome : celui-ci travaille en duo avec l'ubiquitine (formant le système Ubiquitine-Protéasome) afin d'assurer la dégradation des protéines défectueuses comme je viens de le dire, mais le système
Ubiquitine-Protéasome sert aussi de régulateur, en contribuant au maintien d'un taux constant de protéines au sein de la cellule.
Voilà comment ça se passe : quand une protéine fait l'objet d'un certain type d'ubiquitination (et pour le coup, on sait qu'une polyubiquitination de type K48 mène généralement à sa dégradation), elle est adressée au protéasome.
Qu'est-ce que le protéasome (aussi appelé protéasome 26S) ?
Comme je l'ai dit, il s'agit d'un complexe protéique. Il est formé par l'association de deux sous-complexes régulateurs 19S et d'un cœur catalytique 20S.
Comme je l'ai dit, il s'agit d'un complexe protéique. Il est formé par l'association de deux sous-complexes régulateurs 19S et d'un cœur catalytique 20S.

Les complexes régulateurs 19S sont impliqués dans la reconnaissance du substrat (ou plus précisément de la chaîne d'ubiquitine qu'il porte) et son dépliement.
Quant au cœur catalytique 20S, c'est un canal dans lequel va passer le substrat pour y être dégradé en peptides (qui sont de petites chaînes de quelques acides aminés seulement).
Ces peptides seront ensuite adressés aux lysosomes, où ils finiront saucissonnés en acides aminés.
Ces peptides seront ensuite adressés aux lysosomes, où ils finiront saucissonnés en acides aminés.

Il convient de préciser que la chaîne d'ubiquitine ne va pas accompagner le substrat dans le protéasome.
En effet, juste avant la dégradation, elle est séparée de la protéine cible par des enzymes déubiquitinases (j'avais bien dit que l'ubiquitination était réversible).
En effet, juste avant la dégradation, elle est séparée de la protéine cible par des enzymes déubiquitinases (j'avais bien dit que l'ubiquitination était réversible).
Les déubiquitinases ont non seulement le pouvoir de briser les liens entre la chaîne d'ubiquitines et la protéine, mais aussi de détacher les ubiquitines les unes des autres.
Les ubiquitines ainsi libérées peuvent alors participer à l'ubiquitination de nouveaux substrats.
Les ubiquitines ainsi libérées peuvent alors participer à l'ubiquitination de nouveaux substrats.
Cela dit, en plus de permettre la dégradation des protéines par le protéasome, l'ubiquitination joue aussi un rôle central dans la régulation de la réponse immunitaire lors d'une infection virale.
À ce titre, il faut que je vous parle de son influence dans ce qu'on pourrait appeler la chaîne de production des interférons de type 1. 

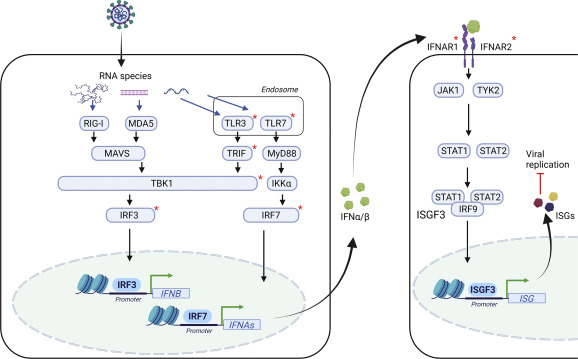
Commençons par la base : lors d'une infection, l'ARN viral peut être reconnu par divers récepteurs comme les TLR3 et TLR7, ou encore RIG-I.
clinicalmicrobiologyandinfection.com/article/S1198-…
clinicalmicrobiologyandinfection.com/article/S1198-…

Suite à cette reconnaissance, une cascade de signaux va se déclencher conduisant à la production d'IFN-α et d'IFN-ß (mais également de cytokines pro-inflammatoires, j'en parlerai un autre jour peut-être), qui eux-mêmes vont induire l'expression des gènes ISG. 
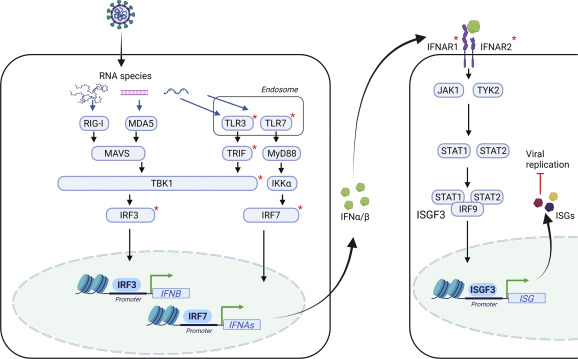
Pour jouer pleinement son rôle dans la cascade, TBK1 a besoin d'être activée, ce qui se produit en deux étapes : d'abord, elle subit une polyubiquitination de type K63, et ensuite, une phosphorylation.
bmcbiol.biomedcentral.com/articles/10.11…
bmcbiol.biomedcentral.com/articles/10.11…
La phosphorylation est un autre type de modification post-traductionnelle réversible.
Elle consiste en l'ajout d'un groupement phosphate sur le substrat, principalement au niveau des résidus sérine, thréonine et tyrosine.
Elle consiste en l'ajout d'un groupement phosphate sur le substrat, principalement au niveau des résidus sérine, thréonine et tyrosine.
Ce groupement phosphate est prélevé sur une adénosine triphosphate (un nucléotide constitué d'adénine, de ribose et de trois groupements phosphates), qui devient donc une adénosine diphosphate au terme de la phosphorylation (ADP). 
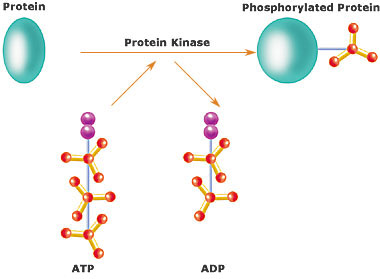
Comme vous aurez pu le voir ci-dessus, la phosphorylation nécessite le concours d'une kinase pour transférer le phosphate sur le substrat.
Or, TBK1 est une justement kinase : elle peut donc s'autophosphoryler.
Or, TBK1 est une justement kinase : elle peut donc s'autophosphoryler.
Une fois activée, TBK1 permet la phosphorylation de la protéine IRF3 en aval.
IRF3 avait justement besoin de cette modification post-traductionnelle être transférée dans le noyau de la cellule et y déclencher la transcription du gène codant pour l'IFN-β.
IRF3 avait justement besoin de cette modification post-traductionnelle être transférée dans le noyau de la cellule et y déclencher la transcription du gène codant pour l'IFN-β.

En résumé, l'ubiquitination de TBK1 est essentielle à sa phosphorylation ultérieure, puis à la phosphorylation de IRF3, laquelle mène ensuite à la production d'IFN-β.
Cependant, comme je vous l'ai signifié tout à l'heure, la PLPro de SARS-CoV-2 possède une fonction déubiquitinase : cela signifie qu'elle peut retirer les chaînes d'ubiquitine de leurs substrats !
Or, sans ubiquitination, point de phosphorylation pour TBK1 et IRF3, ce qui réduit la production d'IFN-β en aval...
Pour confirmer les effets délétères de PLPro, on peut toujours regarder ce qui se passe quand on l'inhibe.
Et sans surprise, les niveaux de phosphorylation de TBK1 et d'IRF3 ont augmenté en présence d'un inhibiteur de PLPro.
nature.com/articles/s4158…
Et sans surprise, les niveaux de phosphorylation de TBK1 et d'IRF3 ont augmenté en présence d'un inhibiteur de PLPro.
nature.com/articles/s4158…
PLpro diminue la synthèse d'IFN-β.
Et malheureusement, ça ne s'arrête pas là...
⬇️⬇️⬇️⬇️⬇️
Et malheureusement, ça ne s'arrête pas là...
⬇️⬇️⬇️⬇️⬇️
Parlons maintenant de l'ISGylation.
Comme on l'a vu, une cellule a de quoi détecter sa propre infection par un virus, et, en réponse à cette détection, produire des IFN-I.
Comme on l'a vu, une cellule a de quoi détecter sa propre infection par un virus, et, en réponse à cette détection, produire des IFN-I.

Suite à leur synthèse, ces IFN-I vont activer quant à eux la voie JAK/STAT, ce qui entraînera la fabrication de nombreuses protéines codées par les gènes ISG (interferon-stimulated-gene). 

Parmi ces protéines, il y a notamment ISG15 : elle appartient à ce que l'on appelle la « famille de l'ubiquitine ».
Tout simplement, c'est une protéine « ubiquitine-like » (UbL).
Tout simplement, c'est une protéine « ubiquitine-like » (UbL).
Ces UbL présentent en effet des structures homologues à celle de l'ubiquitine (en dépit de nombreuses singularités, paradoxalement), et, tout comme cette dernière, peuvent se conjuguer à d'autres protéines pour les modifier (d'une manière réversible) post-traductionnellement,
ce qui affecte leur stabilité, leurs interactions et leurs fonctions entre autres.
Dans le cas d'ISG15, cette modification post-traductionnelle se nomme l'ISGylation.
Dans le cas d'ISG15, cette modification post-traductionnelle se nomme l'ISGylation.
À l'instar de l'ubiquitination, l'ISGylation se produit en trois étapes médiées par trois enzymes différentes (la troisième enzyme est généralement HERC5, je le précise pour ce qui va suivre), 

et c'est également une MPT réversible, l'enzyme USP18 (connue aussi sous le nom de UBP43, comme en atteste le schéma du dessus) ayant la capacité de déconjuguer ISG15 et son substrat (on parle alors de désISGylation de la protéine).
jbc.org/article/S0021-…
jbc.org/article/S0021-…
Malheureusement pour nous, USP18 n'a pas le monopole de cette déconjugaison puisque, comme je vous l'ai déjà dit il y a un moment, PLPro possède elle aussi des fonctions de désISGylation...
Comment la désISGylation profite-t-elle au virus ?
Pour s'en faire une idée, il faut déjà connaître un peu mieux les propriétés antivirales d'ISG15.
Mais là, je vous préviens, ça dépend largement du virus concerné.
Pour s'en faire une idée, il faut déjà connaître un peu mieux les propriétés antivirales d'ISG15.
Mais là, je vous préviens, ça dépend largement du virus concerné.

Quoi qu'il en soit, si on voulait faire un tour d'horizon global, on pourrait au moins commencer par dire que l'ISG15 antagonise la réplication des virus en intervenant soit sur les protéines virales, soit sur les protéines de l'hôte.
Pour ce qui est de l'action sur les protéines virales, il faut savoir que l'ISGylation, de par la localisation d'HERC5 (souvenez-vous, c'est la principale médiatrice de l'ISGylation en tant que troisième enzyme du processus), est en mesure de cibler des protéines naissantes.
Or, quelles sont les protéines naissantes dans une cellule infectée ? La plupart du temps, des protéines virales. Elles sont donc directement exposées à ISG15.
En cas d'ISGylation de ces protéines virales leurs interactions ou leurs fonctions pourront s'en trouver perturbées, ce qui aura pour conséquence d'entraver la réplication virale.
D'autre part, ISG15 peut empêcher certains virus nouvellement formés de quitter la cellule, en intervenant cette fois-ci sur les protéines de l'hôte qui auraient dû permettre la libération du pathogène.
Enfin, plusieurs études ont mis en évidence des propriétés immunomodulatrices chez l'ISG15 non conjuguée (non fixée à un substrat), laquelle intervient pour réguler le niveau de la réponse inflammatoire.
nature.com/articles/s4157…
nature.com/articles/s4157…
Il y aurait donc beaucoup à dire, mais je vous laisse écumer la biblio si ça vous intéresse. Moi, j'aimerais bien qu'on se focalise aujourd'hui sur la voie interféron.
En plus, c'est très simple. Vous allez voir.
En plus, c'est très simple. Vous allez voir.
Comme vous le savez maintenant, la protéine IRF3 phosphorylée va être transférée dans le noyau pour initier la transcription du gène codant pour l'IFN-β. 

Si on s'arrête là, tout va bien.
Le problème, c'est qu'IRF3 finit par être ubiquitinée (une ubiquitination favorisée par l'interaction d'IRF3 avec une autre protéine du nom de Pin1) puis adressée au protéasome pour y subir une dégradation.
Le problème, c'est qu'IRF3 finit par être ubiquitinée (une ubiquitination favorisée par l'interaction d'IRF3 avec une autre protéine du nom de Pin1) puis adressée au protéasome pour y subir une dégradation.
Or, dans le cadre d'une infection virale, ce serait bien mieux si on pouvait prolonger son activité transcriptionnelle, car on a besoin d'interférons.
Pour ce faire, il faut donc empêcher l'ubiquitination trop rapide d'IRF3.
Pour ce faire, il faut donc empêcher l'ubiquitination trop rapide d'IRF3.
Et ça, c'est ISG15 qui va s'en charger.
En effet, l'ISGylation d'IRF3 (médiée par HERC5) a pour effet de perturber l'interaction IRF3/Pin1, et donc l'ubiquitination subséquente d'IRF3.
En effet, l'ISGylation d'IRF3 (médiée par HERC5) a pour effet de perturber l'interaction IRF3/Pin1, et donc l'ubiquitination subséquente d'IRF3.
L'ISGylation d'IRF3 empêche son ubiquitination et augmente du même coup l'intensité de la réponse interférons.
journals.asm.org/doi/10.1128/MC…
journals.asm.org/doi/10.1128/MC…
Malheureusement, PLPro, de par sa fonction de déISGylation, réduit l'ISGylation d'IRF3, ce qui favorise son ubiquitination plus rapide, régulant de nouveau à la baisse la production d'IFN-β.
nature.com/articles/s4158…
nature.com/articles/s4158…
Précisons par ailleurs que la PLPro de SARS-CoV-2, contrairement à celle de SARS-CoV *, a bien plus d'affinités pour l'ISGylation que pour la déubiquitination. 

Il n'empêche. Entre la déubiquitination de TBK1 et la désISGylation d'IRF3, ce virus a quand même plusieurs cordes à son arc (ou plusieurs arcs à son flèche, si quelqu'un a la ref) pour diminuer l'intensité de la réponse interféron. 

Et comme si cela ne suffisait pas, ce diable de SARS-CoV-2 réduit encore un peu plus la fabrication d'interférons en exploitant l'apoptose, qui est un mécanisme de défense antivirale censé inhiber sa réplication !
https://twitter.com/Locuste_/status/1558795621166972928
On peut faire un clin d'œil à @ericbillyfr qui avait prévenu très tôt dans la crise que ce virus perturbait la voie interféron.
Seulement, à l'époque, on ne savait pas trop comment il s'y prenait, quels leviers il actionnait.
Aujourd'hui, nous avons beaucoup plus de réponses.
Seulement, à l'époque, on ne savait pas trop comment il s'y prenait, quels leviers il actionnait.
Aujourd'hui, nous avons beaucoup plus de réponses.

Ajoutons qu'en dehors des stratégies du virus pour mettre en échec l'immunité innée, la réponse interférons est naturellement déficiente chez certaines personnes.
En effet, plus de 20% des formes sévères ont des causes génétiques et immunologiques.
nature.com/articles/s4158…
En effet, plus de 20% des formes sévères ont des causes génétiques et immunologiques.
nature.com/articles/s4158…
Pour la cause génétique, il s'agit de mutations au niveau des gènes TLR3 et TLR7, qui codent, comme leur nom l'indique, pour les récepteurs TLR3 et TLR7.
Vous comprenez bien que si quelque chose cloche au niveau de ces sentinelles de l'immunité, la production d'IFN-I en pâtit.
Vous comprenez bien que si quelque chose cloche au niveau de ces sentinelles de l'immunité, la production d'IFN-I en pâtit.
Pour ce qui est maintenant de la cause immunologique, il se trouve simplement que certaines personnes produisent des auto-anticorps (dont la quantité augmente avec l'âge) qui vont neutraliser les IFN-I, bloquant ainsi leur action.
Tout ça nous permet de dire que la qualité de la réponse interféron n'est pas le fruit d'un hasard total : il y a bel et bien des personnes beaucoup plus à risque de forme sévère que d'autres.
Seulement, impossible de savoir si on est vulnérable avant sa rencontre avec le virus (sauf en cas de recherche de ces auto-anticorps visant les IFN-I).
C'est pourquoi il reste plus prudent de se faire vacciner pour acquérir une immunité adaptative.
C'est pourquoi il reste plus prudent de se faire vacciner pour acquérir une immunité adaptative.
Dans le plupart des cas, le vaccin vous protège contre les formes sévères.
Alors oui, il ne faut pas cacher que la présence de ces auto-anticorps ciblant les IFN-I (et dont la quantité augmente avec l'âge comme on l'a vu) se trouve également à l'origine d'une partie des rares formes sévères qui surviennent chez les vaccinés.
science.org/doi/10.1126/sc…
science.org/doi/10.1126/sc…
Soulignons toutefois que malgré leurs formes sévères, les patients de l'étude ne sont pas morts, ce qui suggère quand même une protection vaccinale, peut-être modérée contre les formes sévères, mais bel et bien présente contre le risque de décès.
Une autre étude vient d'ailleurs confirmer ces données.
Même quand le vaccin n'a pas réussi à vous éviter une forme sévère, il peut toujours vous sauver la vie - ce qui n'a rien d'accessoire, disons-le clairement.
Il faut donc se faire vacciner.
jamanetwork.com/journals/jama/…
Même quand le vaccin n'a pas réussi à vous éviter une forme sévère, il peut toujours vous sauver la vie - ce qui n'a rien d'accessoire, disons-le clairement.
Il faut donc se faire vacciner.
jamanetwork.com/journals/jama/…
Quant aux traitements, on sait que le Paxlovid réduit beaucoup le risque de forme sévère, mais seulement chez les plus de 65 ans, ce qui, conjugué à son accès difficile, rend plus que jamais nécessaire l'enrichissement de l'arsenal thérapeutique.
nejm.org/doi/full/10.10…
nejm.org/doi/full/10.10…
Peut-être que le prochain traitement à obtenir une autorisation de mise sur le marché ciblera PLPro ?
Le cas échéant, n'oubliez pas que vous en aurez entendu parler ici la première fois.
Le cas échéant, n'oubliez pas que vous en aurez entendu parler ici la première fois.

Plus sérieusement, PLPro est une cible alléchéante comme nous l'avons vu : son inhibition efficace pourrait non seulement réduire la réplication virale, mais également améliorer la qualité de la réponse immunitaire innée.
Le bénéfice serait double.
Le bénéfice serait double.
Alors bien sûr, on ne m'a pas attendue pour essayer toutes sortes de molécules, et même, sachez-le, des composés phénoliques !
nature.com/articles/s4200…
nature.com/articles/s4200…
Cela dit, il reste encore beaucoup de chemin à faire.
Il s'agit de trouver un inhibiteur assez puissant pour être prescrit à des doses acceptables, tout en étant bien spécifique de PLPro pour ne pas toucher à nos propres enzymes.
Il s'agit de trouver un inhibiteur assez puissant pour être prescrit à des doses acceptables, tout en étant bien spécifique de PLPro pour ne pas toucher à nos propres enzymes.
Si l'une de ces molécules peut se fixer plus vite que les polyprotéines pp1a et pp1ab dans le site actif de PLpro, elle aura alors des chances de demeurer efficace contre beaucoup de variants car ce site est quand même assez bien conservé (à moins de mutations qui avantagent
énormément l'interaction PLpro/polyprotéines par rapport à PLpro/molécule-traitement, mais bon, pourquoi toujours penser au pire ?)
Cela dit, et pour finir, une dernière étude nous met en garde sur le besoin de tenir compte de la NSP3 toute entière (et pas seulement de PLPro, qui, rappelons-le, n'en est qu'un domaine) au moment de rechercher des inhibiteurs...
En effet, des chercheurs ont découvert que NSP3 était plus prolifique que PLpro seule, laquelle s'est avérée incapable de disjoindre NSP1 de NSP2, et cela même avec des concentrations croissantes de PLPro...
Cela souligne a priori l'importance des autres domaines de NSP3 dans la reconnaissance et le clivage du substrat.
journals.plos.org/plosone/articl…
journals.plos.org/plosone/articl…
Donc, bien sûr, cela nous fait une difficulté supplémentaire dans l'optique d'élaborer d'un traitement.
Mais si on y parvient, on aura acquis un nouveau précieux succès contre ce virus.
En attendant peut-être un vaccin qui empêche de s'infecter...
Mais si on y parvient, on aura acquis un nouveau précieux succès contre ce virus.
En attendant peut-être un vaccin qui empêche de s'infecter...
Ce fil COVID est maintenant terminé.
Toutefois, je ne peux pas vous lâcher sans avoir dit un mot sur le triste anniversaire du jour.
Toutefois, je ne peux pas vous lâcher sans avoir dit un mot sur le triste anniversaire du jour.
Nous sommes aujourd'hui le 11 septembre 2022.
Il y a tout juste 21 ans, se déroulait l'attentat le plus meurtrier de l'histoire, à coups d'avions de ligne détournés, puis utilisés comme des missiles par une équipe de 19 terroristes d'al-Qaeda.
#11septembre2001
Il y a tout juste 21 ans, se déroulait l'attentat le plus meurtrier de l'histoire, à coups d'avions de ligne détournés, puis utilisés comme des missiles par une équipe de 19 terroristes d'al-Qaeda.
#11septembre2001

Au bilan, 3 000 décès immédiats, causés soit par le crash des avions, soit par les flammes, soit par « suicide » pour éviter de mourir brûlés dans les étages supérieurs des deux tours du World Trade Centeur, soit par l'effondrement ultérieur de ces dernières.
Mais aussi, et peut-être surtout, d'innombrables victimes à retardement, qui meurent aujourd'hui encore de pathologies respiratoires déclenchées par les poussières toxiques dues à la chute des tours. 

Sans parler des vies brisées par le traumatisme d'avoir assisté à ce carnage.
Alors bien sûr, on connaît tous à peu près par cœur le déroulé de ces funestes attaques, et il nous arrive à tous d'y penser ou d'en reparler de temps en temps, mais le fait est qu'à mesure qu'on s'en éloigne, forcément, l'émotion diminue (et encore, ça, c'est pour ceux qui
ont vécu l'évènement en direct depuis leur télé).
Moi-même, si j'ai toujours perçu cet évènement comme un drame absolu, je le voyais cependant comme quelque chose de lointain, sans trop d'impact sur ma vie actuelle.
Moi-même, si j'ai toujours perçu cet évènement comme un drame absolu, je le voyais cependant comme quelque chose de lointain, sans trop d'impact sur ma vie actuelle.
Mais curieusement, les commémorations lors du 20ème anniversaire m'ont fait une grande impression et réactivé mon intérêt pour cette tragédie, que j'ai alors étudiée un peu plus en profondeur.
Ayant beaucoup appris (j'suis béton sur les passagers et même les terroristes), j'ai même songé à lui consacrer un thread à part entière ; je ne pense pas qu'il trouverait son public.
Quoi qu'il en soit, n'oublions jamais cet évènement, ni son poids dans la marche du monde.
Symboliquement, on pourrait dire que c'est le 11 septembre qui a mis fin aux années 90, ces années où, après la victoire du monde libre sur le bloc soviétique, on s'était pris à croire en la paix éternelle.
Le 11 septembre a marqué un brusque retour sur terre ; avec lui, c'était l'avènement d'un monde multipolaire, bien plus complexe qu'on ne l'avait imaginé.
C'est aussi le point de départ d'une ère de surveillance globale au nom de la lutte contre le terrorisme, avec son cortège de lois sécuritaires (comme le Patriot Act) bientôt exportées en Europe, et de collectes de données personnelles entre autres.
C'est également l'un des terreaux du conspirationnisme contemporain (et si jamais certaines théories complotistes ont pu vous séduire, ou même vous séduisent encore, je ne saurais que trop vous recommander @debunkeretoiles, qui est lui aussi passé par là avant d'en sortir).
C'est, enfin, la cause d'interventions militaires aussi vaines que coûteuses en milliards (tout ça pendant que la Chine se développait) et en vies humaines, lesquelles n'auront finalement servi qu'à doper le terrorisme international - avec les répercussions que l'on sait
pour nous autres Français.
En un mot comme en cent, le 11 septembre et ses retombées ont façonné le monde dans lequel on vit aujourd'hui.
Une bonne raison de ne jamais l'oublier.
Une bonne raison de ne jamais l'oublier.

Voilà, c'est fini pour aujourd'hui !
J'espère que ce thread vous aura plu.
Si oui, je vous propose de le RT, ça me ferait quand même plaisir (au lieu de m'unfollow comme les 40 que ça faisait chier de me voir dans leur TL, eux qui m'avaient sûrement follow suite un thread).
J'espère que ce thread vous aura plu.
Si oui, je vous propose de le RT, ça me ferait quand même plaisir (au lieu de m'unfollow comme les 40 que ça faisait chier de me voir dans leur TL, eux qui m'avaient sûrement follow suite un thread).
Dites-moi aussi en commentaire si vous avez tout compris de votre lecture, et par conséquent si j'ai atteint mon objectif ou pas ! 🥶
Pour patienter jusqu'au prochain épisode, n'hésitez pas à lire ou relire mes autres threads !
https://twitter.com/Locuste_/status/1461303015781060608
Quant à moi, je vous laisse en musique.
(À mettre à fond dans sa bagnole.)
(À mettre à fond dans sa bagnole.)
Poke : @EricBillyFR @Le___Doc @duxpacis @barriere_dr @ChatSecouriste @lethiecv @saiyanbio @Tipuncho @Sonic_urticant @lionel_case @les_vaxxeuses @astropierre @MathieuMolimard @marieBCard @Mad_Epstein, etc.
(Si vous souhaitez vous abonner à mes threads ou sortir de la liste, faites-le-moi savoir.)
* Un peu plus tard... *
Moi : « Encore une bonne chose de faite ! Et on a partagé de la littérature comme jamais, cette fois-ci. »
Tikki : « On a bien fait, PubMed c'est la vie, Marinette ! »
Moi : « Absolument ! On n'a besoin de rien d'autre. »
Moi : « Encore une bonne chose de faite ! Et on a partagé de la littérature comme jamais, cette fois-ci. »
Tikki : « On a bien fait, PubMed c'est la vie, Marinette ! »
Moi : « Absolument ! On n'a besoin de rien d'autre. »

@threadreaderapp unroll please
• • •
Missing some Tweet in this thread? You can try to
force a refresh