1️⃣ #Hydrogène : H
L'élément le plus insipide du tableau périodique. On le retrouve littéralement partout, le normie par excellence.
Le boug compose plus de 90% de l'Univers mais il est pas foutu d'être présent dans l'atmosphère de notre planète 😩 (ça aurait été trop simple)
L'élément le plus insipide du tableau périodique. On le retrouve littéralement partout, le normie par excellence.
Le boug compose plus de 90% de l'Univers mais il est pas foutu d'être présent dans l'atmosphère de notre planète 😩 (ça aurait été trop simple)

A la place, il se planque dans les molécules d'eau (H2O, 2 atomes sur 3 ma gueule) et la matière organique (inséparable de son bro le carbone).
Bref, pour l'utiliser, faut déjà l'extraire de la matière, et ça coûte cher en énergie 💸
Bref, pour l'utiliser, faut déjà l'extraire de la matière, et ça coûte cher en énergie 💸

On l'extrait sous la forme de dihydrogène (H2) que tout le monde appelle "hydrogène" car merde, la vie est trop courte pour dire "dihydrogène", de toute façon la nomenclature c'est le dernier problème de l'humanité.
Le seul truc cool avec ce gaz, c'est qu'il est inflammable 🔥
Le seul truc cool avec ce gaz, c'est qu'il est inflammable 🔥
Cette transformation, vous la connaissez :
2 H2 + O2 -> 2 H2O (encore de la flotte purée)
L'hydrogène est donc relou à transporter : risque de flamme, voire d'explosion. Pour des raisons de sécurité, le stockage des bouteilles de gaz doit suivre une réglementation spécifique.
2 H2 + O2 -> 2 H2O (encore de la flotte purée)
L'hydrogène est donc relou à transporter : risque de flamme, voire d'explosion. Pour des raisons de sécurité, le stockage des bouteilles de gaz doit suivre une réglementation spécifique.

Étudier des gaz, c'est pas évident, mais le fait que H2 brûle a facilité son identification :
"Air inflammable" chez son découvreur Cavendish (1766)
"Hydrogène" pour Lavoisier qui s'est pas emmerdé avec un nom signifiant "qui génère de l'eau" (vous avez la ref maintenant !)

"Air inflammable" chez son découvreur Cavendish (1766)
"Hydrogène" pour Lavoisier qui s'est pas emmerdé avec un nom signifiant "qui génère de l'eau" (vous avez la ref maintenant !)


S'il est aussi abondant dans l'Univers, c'est parce qu'il est le principal composant et carburant des étoiles.
Mais attention ! Ici il ne brûle pas, il fusionne selon un mécanisme complexe qu'on peut résumer vulgairement par :
H + H -> He
Et ça génère aussi bcp d'énergie !
Mais attention ! Ici il ne brûle pas, il fusionne selon un mécanisme complexe qu'on peut résumer vulgairement par :
H + H -> He
Et ça génère aussi bcp d'énergie !
Si H2 intéresse autant, c'est pour l'énergie qu'on peut en extraire grâce à ses 2 comportements ⬇️
(1) il brûle : son explosion peut faire tourner des moteurs thermiques
(2) il fusionne : réacteur à fusion nucléaire (comme le démonstrateur ITER) pour générer de l'électricité

(1) il brûle : son explosion peut faire tourner des moteurs thermiques
(2) il fusionne : réacteur à fusion nucléaire (comme le démonstrateur ITER) pour générer de l'électricité


Petite subtilité technologique : il existe aussi des moteurs fonctionnant à l'hydrogène mais électrique et PAS thermique.
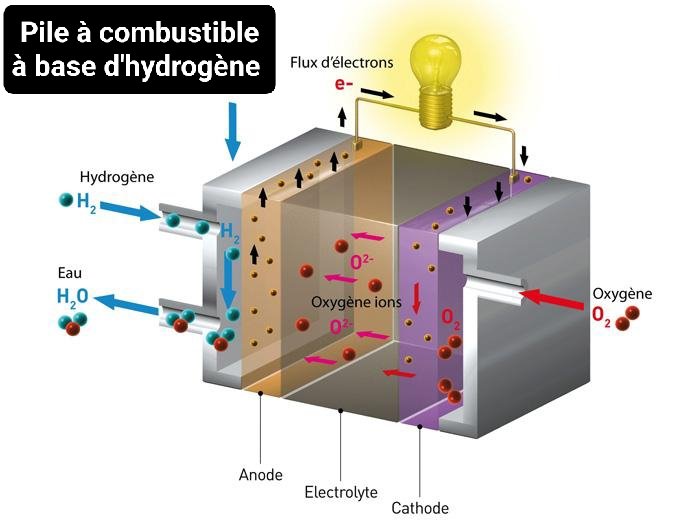
Le moteur tourne grâce à un courant électrique, lui-même généré par la réaction entre H2 et O2 ayant lieu au sein d'une pile qu'on nomme "pile à combustible"

Le moteur tourne grâce à un courant électrique, lui-même généré par la réaction entre H2 et O2 ayant lieu au sein d'une pile qu'on nomme "pile à combustible"

Mais bref, pour résumer :
Paradoxalement, l'hydrogène en tant qu'atome est omniprésent mais très peu disponible sous la forme qui nous (homo sapiens énergivore) intéresse, c'est à dire le dihydrogène "H2".
Ce dernier doit d'abord être produit (ou extrait) pour être utilisé.
Paradoxalement, l'hydrogène en tant qu'atome est omniprésent mais très peu disponible sous la forme qui nous (homo sapiens énergivore) intéresse, c'est à dire le dihydrogène "H2".
Ce dernier doit d'abord être produit (ou extrait) pour être utilisé.
Bonus : Ci-dessous un enregistrement très rare de la réaction chimique entre 2 atomes d'hydrogène et 1 atome d'oxygène, formant 1 molécule d'eau.
Crédit : Meow et al. 1992
Crédit : Meow et al. 1992
• • •
Missing some Tweet in this thread? You can try to
force a refresh




















