Aviez-vous déjà de l'encre de votre stylo-plume dans de l'eau chaude ? Vous devriez, car le résultat risque de vous étonner. 🙂
Petit thread Twitter à propos de l'expérience que je vous avais présenté hier sur le #CephalusLive. C'est parti !
(1/n) 👇
Petit thread Twitter à propos de l'expérience que je vous avais présenté hier sur le #CephalusLive. C'est parti !
(1/n) 👇

#LT 2/n
Mettons un peu de contexte : j'étais tranquillement en train de regarder la dernière vidéo de @dlouapre (abonnez-vous) et il a voulu illustrer la notion de diffusion à l'aide d'une goutte d'encre bleue d'une cartouche dans un verre d'eau chaude.
🎞
Mettons un peu de contexte : j'étais tranquillement en train de regarder la dernière vidéo de @dlouapre (abonnez-vous) et il a voulu illustrer la notion de diffusion à l'aide d'une goutte d'encre bleue d'une cartouche dans un verre d'eau chaude.
🎞

#LT 3/n
Et voilà le résultat que David Louapre obtient à la fin... est-ce que ce que vous auriez prédit ?
Et voilà le résultat que David Louapre obtient à la fin... est-ce que ce que vous auriez prédit ?

#LT 5/n
Je suis à peu près sûr que vous vous attendiez plutôt à un résultat de ce type : une solution uniformément bleue.
Et non, la chimie est partout pour tout compliquer et rendre la vie plus excitante. 😊
(ici, j’ai triché un peu, et je vais vous expliquer comment)
Je suis à peu près sûr que vous vous attendiez plutôt à un résultat de ce type : une solution uniformément bleue.
Et non, la chimie est partout pour tout compliquer et rendre la vie plus excitante. 😊
(ici, j’ai triché un peu, et je vais vous expliquer comment)
#LT 6/n
Un moyen d'évitez ça, c'est d'utiliser autre chose que de l'encre, comme du colorant alimentaire.
C'est ce que vous proposait @SciTania dans une #PtitesManips pour distinguer eau chaude et eau froide.
Allez voir sa chaîne, c'est trop bien !
🎞
Un moyen d'évitez ça, c'est d'utiliser autre chose que de l'encre, comme du colorant alimentaire.
C'est ce que vous proposait @SciTania dans une #PtitesManips pour distinguer eau chaude et eau froide.
Allez voir sa chaîne, c'est trop bien !
🎞

#LT 7/n
Et cette décoloration de l'encre bleue, c'est quelque chose d'assez connu entre médiateurs scientifiques qui font cette manip (sauf de David Louapre... sorry 😅)
Par exemple, @Paul_Bonif nous le rappelait lors d'un live @AssoTraces à l'@ESPGG :
Et cette décoloration de l'encre bleue, c'est quelque chose d'assez connu entre médiateurs scientifiques qui font cette manip (sauf de David Louapre... sorry 😅)
Par exemple, @Paul_Bonif nous le rappelait lors d'un live @AssoTraces à l'@ESPGG :

#LT 8/n
Pour comprendre comment ça marche, qui de mieux que @gourmaud_jamy, qui s'est mis à YouTube depuis le confinement !
🎞
Pour ce qui nous intéresse ici, l'encre bleue doit sa couleur au bleu d'aniline.
Pour comprendre comment ça marche, qui de mieux que @gourmaud_jamy, qui s'est mis à YouTube depuis le confinement !
🎞
Pour ce qui nous intéresse ici, l'encre bleue doit sa couleur au bleu d'aniline.

#LT 9/n
Le bleu d’aniline contenu dans la cartouche :
- absorbe beaucoup la lumière rouge et verte 🔴🟢👎
- laisse passer énormément de lumière bleue 🔵👍
Conséquence pour nos yeux : on reçoit surtout de la lumière bleue, l’encre du stylo plume est bleue en lumière blanche
Le bleu d’aniline contenu dans la cartouche :
- absorbe beaucoup la lumière rouge et verte 🔴🟢👎
- laisse passer énormément de lumière bleue 🔵👍
Conséquence pour nos yeux : on reçoit surtout de la lumière bleue, l’encre du stylo plume est bleue en lumière blanche
#LT 10/n
Le bleu d'aniline est en fait un mélange qui regroupe plusieurs types de colorants, dont le bleu de méthyle (Acid Blue 93) représenté ci-dessous.
Je cite celui-ci car c'est l'un qui a le plus de traces dans la littérature, comme cet article.
📄 doi.org/10.1002/sscp.2…
Le bleu d'aniline est en fait un mélange qui regroupe plusieurs types de colorants, dont le bleu de méthyle (Acid Blue 93) représenté ci-dessous.
Je cite celui-ci car c'est l'un qui a le plus de traces dans la littérature, comme cet article.
📄 doi.org/10.1002/sscp.2…

#LT 11/n
Le bleu d'aniline fait partie de la grande famille des colorants "triphénylméthyl" car la structure de base est un atome de carbone central entouré de trois cycles benzéniques.
Je vous présente un autre membre de la famille, le violet de méthyle (ou crystal violet)
Le bleu d'aniline fait partie de la grande famille des colorants "triphénylméthyl" car la structure de base est un atome de carbone central entouré de trois cycles benzéniques.
Je vous présente un autre membre de la famille, le violet de méthyle (ou crystal violet)

#LT 12/n
Remarquez que ce carbone central semble ne pas avoir ses 4 liaisons habituelles. En effet, il porte une charge positive, donc il n'a que 3 électrons à offrir.
On appelle ça "carbocation" et il est stabilisé par les cycles aromatiques autour.
charge :➕🔵⚪🔴➖
Remarquez que ce carbone central semble ne pas avoir ses 4 liaisons habituelles. En effet, il porte une charge positive, donc il n'a que 3 électrons à offrir.
On appelle ça "carbocation" et il est stabilisé par les cycles aromatiques autour.
charge :➕🔵⚪🔴➖

#LT 13/n
Et ce type de structure, c'est un immense terrain de jeu pour les électrons.
Si vous avez vu au lycée le concept de liaisons conjuguées, on est en plein dedans : les électrons peuvent se délocaliser sur les trois cycles, permettant l'absorption de photon dans le visible.
Et ce type de structure, c'est un immense terrain de jeu pour les électrons.
Si vous avez vu au lycée le concept de liaisons conjuguées, on est en plein dedans : les électrons peuvent se délocaliser sur les trois cycles, permettant l'absorption de photon dans le visible.
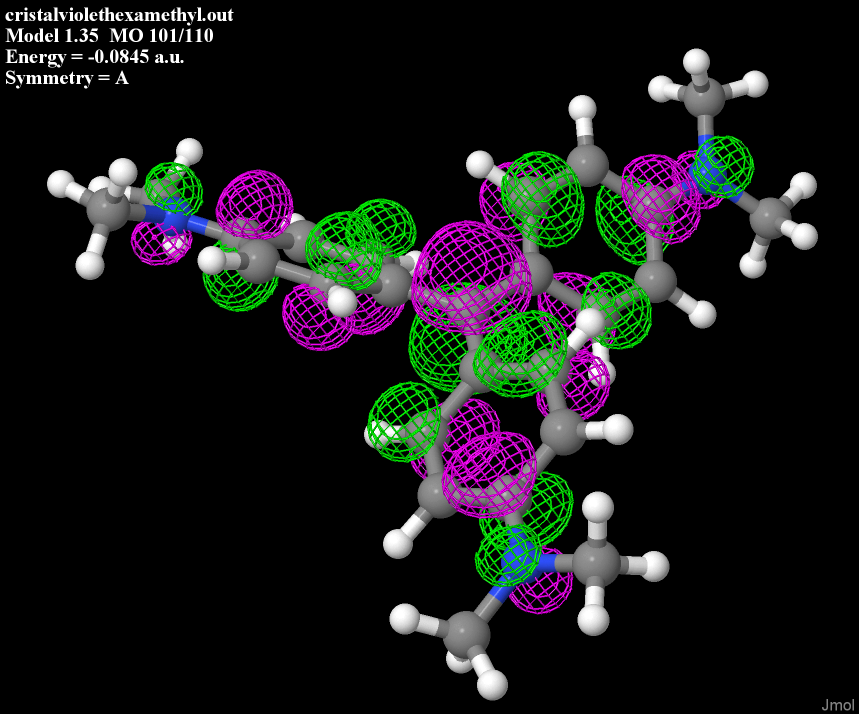
#LT 14/n
Et comment fonctionne un effaceur ? Celui-ci contient, comme le dit @gourmaud_jamy, du bisulfite de sodium.
C'est ce qu'on appelle un réducteur : il va donner des électrons au colorant, ce qui va modifier sa structure et réduire le terrain de jeu des électrons.
Et comment fonctionne un effaceur ? Celui-ci contient, comme le dit @gourmaud_jamy, du bisulfite de sodium.
C'est ce qu'on appelle un réducteur : il va donner des électrons au colorant, ce qui va modifier sa structure et réduire le terrain de jeu des électrons.

#LT 15/n
Ici, j’ai utilisé comme réducteur du dithionite de sodium : la décoloration de l’encre se fait très rapidement. Heureusement, car on veut pouvoir corriger une faute rapidement.
Ici, j’ai utilisé comme réducteur du dithionite de sodium : la décoloration de l’encre se fait très rapidement. Heureusement, car on veut pouvoir corriger une faute rapidement.
#LT 16/n
Mais ce qui va nous intéresser, c’est ce qui se passe si je rajoute une base à mon encre.
Il faut que le pH soit relativement haut, donc j’ai utilisé de l’hydroxyde de potassium : mon encre bleue passe au rouge pâle.
Mais ce qui va nous intéresser, c’est ce qui se passe si je rajoute une base à mon encre.
Il faut que le pH soit relativement haut, donc j’ai utilisé de l’hydroxyde de potassium : mon encre bleue passe au rouge pâle.
#LT 17/n
Et c’est pas la fin : si on patiente, on voit que le rouge devient de plus en plus pâle, et même totalement devenir incolore.
Qu’a-t-il bien pu se passer ? 🤔
Et c’est pas la fin : si on patiente, on voit que le rouge devient de plus en plus pâle, et même totalement devenir incolore.
Qu’a-t-il bien pu se passer ? 🤔
@dlouapre #LT 2'/n
J'ai mal retranscrit le propos de David Louapre : il voulait illustrer la DISSIPATION. 😶
Et on fait bien de me reprendre : ce n'est clairement pas diffusif mais convectif, sinon il aurait fallu un très très très très long timelapse.
J'ai mal retranscrit le propos de David Louapre : il voulait illustrer la DISSIPATION. 😶
Et on fait bien de me reprendre : ce n'est clairement pas diffusif mais convectif, sinon il aurait fallu un très très très très long timelapse.
#LT 18/n
Dans une solution aqueuse basique, on a plein d'ions hydroxyde HO⁻. Ce sont un ion négatif avec un carbocation positif : es deux charges opposées s'attirent et une liaison se forme.
Et ça coupe la délocalisation des électrons entre les cycles : perte de la couleur
Dans une solution aqueuse basique, on a plein d'ions hydroxyde HO⁻. Ce sont un ion négatif avec un carbocation positif : es deux charges opposées s'attirent et une liaison se forme.
Et ça coupe la délocalisation des électrons entre les cycles : perte de la couleur

#LT 19/n
Et pour faire revenir la couleur ? Il suffit de rajouter un acide : les ions H⁺ de l’acide vont retirer le groupement -OH en formant de l’eau, et le carbocation coloré est régénéré.
Et pour faire revenir la couleur ? Il suffit de rajouter un acide : les ions H⁺ de l’acide vont retirer le groupement -OH en formant de l’eau, et le carbocation coloré est régénéré.
#LT 20/n
Vous pouvez utiliser un acide solide comme de l’acide citrique, ça vous donnera des jolis effets lorsque l’encre réapparaîtra. 😃
Vous pouvez utiliser un acide solide comme de l’acide citrique, ça vous donnera des jolis effets lorsque l’encre réapparaîtra. 😃
#LT 21/n
Mais quel rapport avec l’eau chaude et les ions HO⁻ ?
Et bien... j’ai pas trouvé de bibliographie définitive dessus, j’ai que des hypothèses :
- départ du CO₂ dissous, qui est acide
- chauffer augmente la dissociation de l’eau et la cinétique de l’attaque du colorant
Mais quel rapport avec l’eau chaude et les ions HO⁻ ?
Et bien... j’ai pas trouvé de bibliographie définitive dessus, j’ai que des hypothèses :
- départ du CO₂ dissous, qui est acide
- chauffer augmente la dissociation de l’eau et la cinétique de l’attaque du colorant
#LT 22/n
Si vous avez d'autres pistes, je suis preneur. Je continue mon enquête de mon côté.
Mais si vous voulez révéler les secrets effacés, vous savez comment faire : sortir les acides !
Si vous avez d'autres pistes, je suis preneur. Je continue mon enquête de mon côté.
Mais si vous voulez révéler les secrets effacés, vous savez comment faire : sortir les acides !
#LT 23/n
⚠ Et c'est le moment des erratums : en écrivant trop vite, j'ai introduit une grossière erreur dans mon deuxième message.
Mes excuses à @dlouapre, qui n'a bien entendu pas parlé de "diffusion" comme je l'ai écrit, mais de "dispersion".😫
⚠ Et c'est le moment des erratums : en écrivant trop vite, j'ai introduit une grossière erreur dans mon deuxième message.
Mes excuses à @dlouapre, qui n'a bien entendu pas parlé de "diffusion" comme je l'ai écrit, mais de "dispersion".😫
https://twitter.com/brusicor02/status/1310668461765525511?s=20
#LT 24/n
Si vous voulez en apprendre un peu plus sur la diffusion, allez consulter les réponses de @a_berut suite à l'interrogation de @SciTania sur les "arc en ciel de skittles".
Moralité : relire son message plus attentivement avant de tweeter.
Si vous voulez en apprendre un peu plus sur la diffusion, allez consulter les réponses de @a_berut suite à l'interrogation de @SciTania sur les "arc en ciel de skittles".
Moralité : relire son message plus attentivement avant de tweeter.
https://twitter.com/SciTania/status/1055820634633265154?s=20
#LT 25/n
J'ai également un problème dans l'image du tweet 12 : comme on me l'a fait remarquer, les azotes n'ont pas une charge négative, mais positive.
En refaisant le calcul avec Hückel, on retrouve bien le résultat attendu.
J'ai également un problème dans l'image du tweet 12 : comme on me l'a fait remarquer, les azotes n'ont pas une charge négative, mais positive.
En refaisant le calcul avec Hückel, on retrouve bien le résultat attendu.
https://twitter.com/Pucheault_Lab/status/1310658155987243008?s=20
#LT 26/n, n=26
C'est ce qui est pratique avec Twitter, les erreurs grossières sont rapidement remontées. Merci à vous de m'avoir lu, et merci de m'avoir également corrigé mes erreurs. 💙
Sur ce, j'ai de la vaisselle de chimie à faire, et je vais aller me reposer les neurones.
C'est ce qui est pratique avec Twitter, les erreurs grossières sont rapidement remontées. Merci à vous de m'avoir lu, et merci de m'avoir également corrigé mes erreurs. 💙
Sur ce, j'ai de la vaisselle de chimie à faire, et je vais aller me reposer les neurones.
• • •
Missing some Tweet in this thread? You can try to
force a refresh























