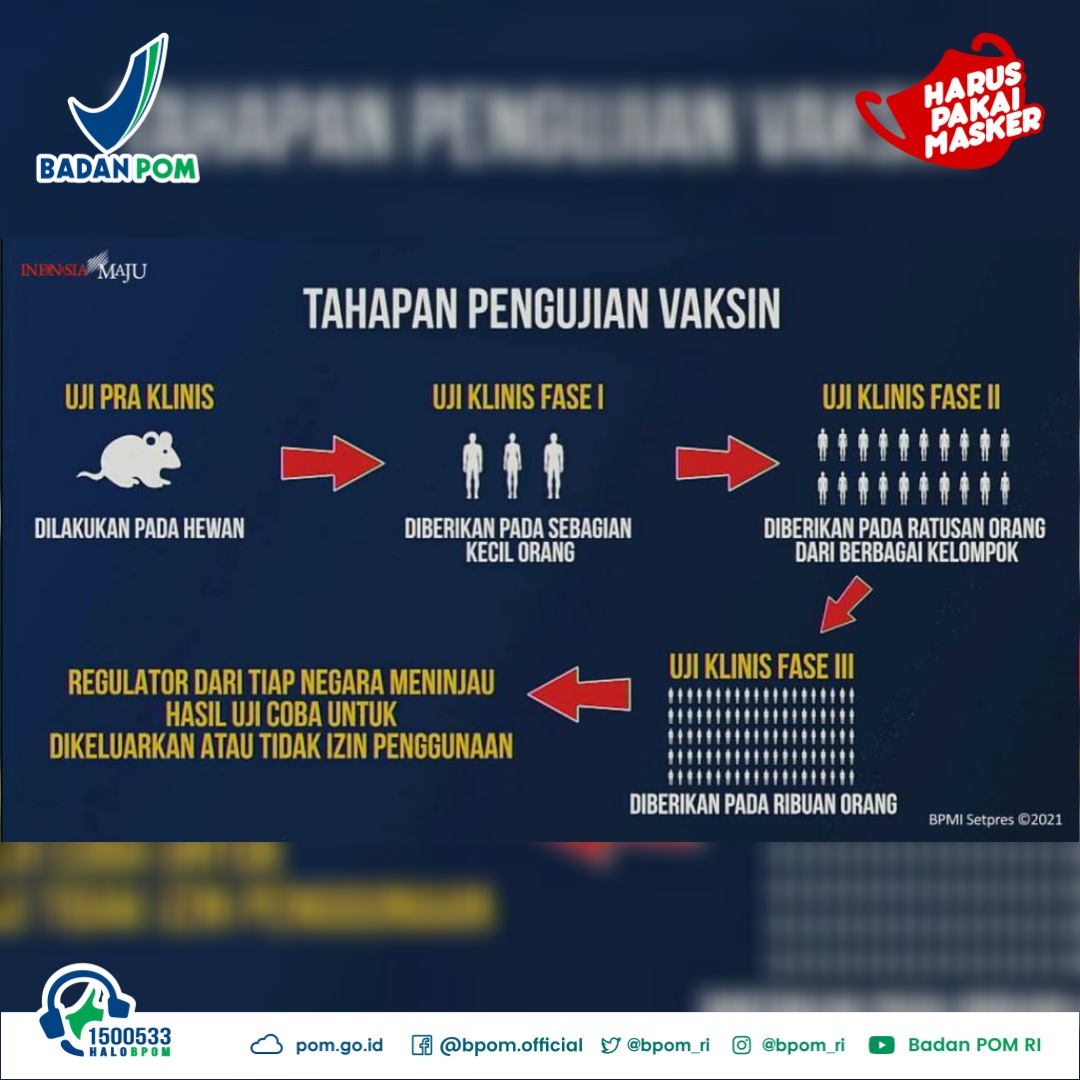
#SahabatBPOM, Badan POM resmi umumkan vaksin coronavac yang diproduksi oleh Sinovac Biotech mendapatkan izin penggunaan dalam kondisi kedaruratan/Emergency Use Authorization. Kepala Badan POM menyampaikan bahwa pemberian izin tersebut didasarkan tiga hal.
.



.




Pertama, efek samping dari vaksin coronavac hanya bersifat ringan dan sedang. Ringan berupa nyeri, iritasi dan sedang berupa pembengkakan sistemik, nyeri otot, demam dan gangguan sakit kepala. Efek samping tersebut tidak berbahaya dan dapat pulih kembali.
.

.


Kedua, efikasi yang diperoleh vaksin ini sebesar 65,3%. Ini berarti dengan vaksinasi, berpotensi menurunkan kemungkinan seseorang terinfeksi sebesar 65,3%. dalam uji kliniknya, vaksin dapat membentuk antibodi yang dapat melawan virus tersebut yaitu 99,74% setelah 14 hari
penyuntikan dan 99,23% setelah 3 bulan.
.
Ketiga, Badan POM dalam menjamin mutu vaksin telah melakukan pengawasan pada bahan baku, proses produksi dan telah melakukan inspeksi langsung ke fasilitas sarana produksi di Tiongkok.
.
Ketiga, Badan POM dalam menjamin mutu vaksin telah melakukan pengawasan pada bahan baku, proses produksi dan telah melakukan inspeksi langsung ke fasilitas sarana produksi di Tiongkok.
Badan POM juga secara rutin mengevaluasi data hasil uji klinik secara bertahap melalui rolling submission yaitu pada 9 desember, 29 desember, 8 januari dan 10 januari. Evaluasi tersebut dilakukan oleh Badan POM bersama Komnas Penilai Obat, ITAGI,
Perhimpunan Alergi Imunologi Indonesia.
.
Jarir at-Thobari, tim komnas penilai obat menyampaikan bahwa uji klinik yang dilakukan di Bandung yang melibatkan Fakultas Kedokteran Universitas Padjajaran dan Biofarma melibatkan masyarakat umum sebagai sampel.
.
Jarir at-Thobari, tim komnas penilai obat menyampaikan bahwa uji klinik yang dilakukan di Bandung yang melibatkan Fakultas Kedokteran Universitas Padjajaran dan Biofarma melibatkan masyarakat umum sebagai sampel.
Ini menjadi keunggulan tersendiri karena berbeda dengan Turki dan Brazil dengan sampel tenaga Kesehatan dan mereka yang berisiko tinggi.
.
Sri Rezeki dari ITAGI dan Iris Rengganis dari Perhimpunan Alergi Imunologi Indonesia menyampaikan bahwa vaksinasi ini tetap mengharuskan
.
Sri Rezeki dari ITAGI dan Iris Rengganis dari Perhimpunan Alergi Imunologi Indonesia menyampaikan bahwa vaksinasi ini tetap mengharuskan
masyarakat patuh pada 3M, karena vaksinasi ini akan dilakukan dua kali untuk memastikan antibodi terbentuk dalam waktu 14 hari hingga 1 bulan. Selain kepatuhan masyarakat, Daeng M Faqih dari PB IDI menghimbau para tenaga kesehatan harus mendukung program vaksinasi ini dan
meminta masyarakat untuk mengakhiri polemik mengenai vaksin tersebut. Asrorun Niam Sholeh dari MUI menyampaikan setelah mendapatkan UEA dari Badan POM, MUI akan melakukan finalisasi fatwa mengenai vaksin tersebut.
.
.
• • •
Missing some Tweet in this thread? You can try to
force a refresh