Durante la vida se pueden tomar malas decisiones. A veces pocas, a veces muchas. Pero ninguna tan mala como la que tomó Thomas Midgley. Un ingeniero mecánico que un día decidió dedicarse a la química, con nefastas consecuencias para nuestro planeta. Esta es su historia. #hilosdc7 

Thomas Midgley Jr nació en 1889 en Pensilvania, EE.UU. Pronto se mudó a Ohio, graduándose en ingeniería mecánica en la Universidad de Cornell con 22 años. Desde pequeño vivió en un entorno que fomentó su afán inventor, lo que le llevó a obtener hasta 170 patentes.
Sin embargo, quizás es mejor que nunca lo hubiese tenido. Tal como veremos a continuación, los inventos de Midgley perfectamente se pueden contar entre los peores de la Humanidad. Un hombre que cambió el planeta donde vivimos. Sin exagerar.
En 1916 es contratado por Dayton Research Laboratories, una empresa subsidiaria del gigante automovilístico General Motors. Comienza a trabajar bajo la supervisión de Charles Kettering, quien le encarga resolver unos de los grandes problemas del momento.
Antes de continuar, debemos ponernos un poco en contexto. Los primeros vehículos impulsados por motores de combustión aparecieron a finales del siglo XIX, aunque aún lejos de ser los que conocemos hoy en día.
Y es aquí donde entra nuestra querida Termodinámica. A través de sus ciclos, podemos describir de forma matemática el funcionamiento de los distintos motores de combustión: ciclo de Otto para motores de gasolina, ciclo de Diesel para motores diésel, etc.
Sin embargo, hoy vamos a limitarnos al primero de ellos. Y, como ejemplo, pondremos un motor de cuatro tiempos, es decir, realiza un ciclo en cuatro fases. En 1876, Nikolaus Otto presenta su trabajo más famoso, tal como se ve aquí: 
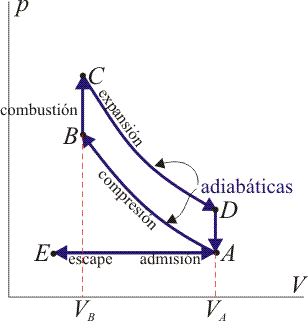
El ciclo (la curva cerrada) consta de cuatro etapas, además de dos extras que dan inicio y final al proceso. Por su parte, el motor de combustión consta de un cilindro, un pistón en su interior y una bujía que genere una chispa. Vamos a comentar cada una de sus fases.
En primer lugar, con el pistón en su posición más baja, una mezcla de aire y gasolina entra en el cilindro. Luego el pistón comienza a subir, comprimiendo la mezcla o combustible y aumentando su temperatura (pero sin arder sola).
Cuando la mezcla ya tiene la temperatura adecuada, una chispa generada por la bujía provoca la ignición, convirtiendo la mezcla de gas y aire en gases de combustión. Dichos gases están a gran temperatura, lo que produce su expansión, empujando el pistón hasta su posición inicial.
Es durante este recorrido cuando la energía química de la gasolina se transforma en energía mecánica para mover el coche. Sí, el movimiento del pistón durante el descenso es justo lo que desplaza tu vehículo. A mayor desplazamiento, más movimiento.
Mientras el pistón vuelve a su posición inicial, los gases salen del cilindro y una nueva mezcla entra para iniciar el ciclo. Así hasta terminar con todo el combustible. Sin embargo, esta es la situación ideal y en 1916 estaba lejos de ser cierta.
Los motores del momento presentaban un grave problema de detonaciones. Vale, el coche no salía volando por los aires, pero sí daba buenos sustos a los conductores. La mezcla explotaba antes de tiempo. En lugar de un empuje suave, el pistón experimentaba un martillazo.
El rendimiento era considerablemente menor, además de que las detonaciones podían provocar graves daños en el motor. Por lo tanto, a Midgley se le encarga la siguiente tarea: aumentar el índice de octanos de la gasolina. Espera, ¿qué?
Definimos el índice de octanos u octanaje como la resistencia de un combustible a detonar. Cuando mayor sea, más energía hay que suministrar para que arda. El problema era que la gasolina detonaba antes de que el pistón hubiera subido del todo, lo que disminuía el rendimiento.
Se necesitaba encontrar algún compuesto que aumentara el octanaje. Así, la mezcla sólo ardería al aplicar a chispa, desplazando el pistón lo máximo posible con un movimiento suave. Se probó con distintos compuestos, pero no fue hasta 1926 cuando se encontró la solución.
Es hora de presentar al tetraetilo de plomo, la primera pésima decisión de Thomas Midgley. Este compuesto, abreviado TEL y cuya fórmula es (C2H5)2Pb, fue descubierto en 1853 por el alemán Löwig, aunque no fue de mayor utilidad hasta que nuestro protagonista tuvo su “genial” idea. 

El TEL aumentaba el octanaje de la gasolina, solucionando el problema de las detonaciones. Todo era perfecto, por fin se había encontrado una solución. Entonces, ¿cuál era el problema? Pista: el plomo es un veneno mortal.
Y, desgraciadamente, no desaparecía con la combustión. Los gases que expulsaba el coche contenían altos niveles de plomo. La atmósfera se estaba llenando de veneno. ¿Lo peor de todo? Las compañías eran conscientes de la peligrosidad de este elemento.
General Motors no tardó en patentar la idea, aunque usando el nombre “Ethyl”, evitando la connotación negativa del plomo. Junto a otras grandes compañías automovilísticas, fundó la Ethyl Corporation, quien obtuvo el monopolio de la gasolina con TEL.
Todo parecía ir muy bien. Sin embargo, los problemas no tardaron en aparecer. El plomo ataca al sistema nervioso, ocasionando dolores de cabeza, irritabilidad, daños renales, dolores abdominales, marcha inestable, convulsiones, coma o, finalmente, la muerte.
Y si trabajas con él, es difícil que no te envenenes de alguna manera. Durante los primeros meses de producción de la nueva gasolina, llegaron a morir mínimo quince trabajadores y muchos más experimentaron fuertes dolores.
En 1924, en pocos días murieron cinco personas de un mismo taller mal ventilado y otras 35 quedaron con daños permanentes. A pesar de la constante campaña de censura empresarial, estos accidentes fueron difíciles de ocultar. Es entonces cuando Midgley decide intervenir.
El 30 de octubre de ese mismo año, Thomas Midlgey convoca una rueda de prensa para tranquilizar a la sociedad. Se echó TEL en las manos y aspiró sus vapores durante un minuto, demostrando que no causaba ningún problema. Como es obvio, mentía.
Midgley conocía perfectamente sus efectos. Los meses anteriores había estado de vacaciones debido a una exposición excesiva al TEL, dejándolo gravemente enfermo, un hecho que mantuvo en secreto. No fue una decisión muy ética…
Tras numerosas polémicas y persecuciones por parte de la compañía fabricante, la gasolina con plomo se dejó de vender en EE.UU en 1973. A partir de ahí, muchos otros países le siguieron. En el caso de España, no desapareció hasta 2002.
Y, a nivel global, la gasolina con plomo dejó de existir a finales de agosto de 2021. Sí, este año. Argelia terminó con sus existencias la semana pasada, convirtiéndose en el último país en hacerlo. Sin embargo, sus efectos no se borrarán tan fácilmente.
Pero, ¡esperad! Esta historia desastrosa no termina aqui. Si algo puede salir mal, saldrá peor (o algo así…). Animado por el éxito de la gasolina con plomo, a Midgley se le encargó otro gran problema de la época: la peligrosidad de las neveras. Si, has leído bien.
Las neveras son en realidad máquinas térmicas, por lo que regresemos a la termodinámica. En su parte trasera, existe un circuito donde circula un líquido refrigerante, absorbiendo calor del interior de la nevera y expulsándolo al exterior. Por eso justo esa parte está calentita.
A principios del siglo pasado, los refrigerantes eran líquidos muy tóxicos, inflamables o explosivos: amoniaco, dióxido de azufre, propano… En 1929, una fuga en Ohio mató a cien personas. Tener una nevera era un lujo para los más ricos, pero también un peligro público.
El objetivo de Midgley era loable: encontrar un compuesto que no fuera inflamable o tóxico y que se pudiera respirar sin problemas. Desgraciadamente, su elección fue terrible para el planeta. Hablamos de los CFC o clorofluorcarbonados.
El primero de estos compuestos, formados por átomos de cloro, flúor y carbono, fue sintetizado por el belga Swarts a finales del siglo XIX, pero Midgley se convirtió en el primero que le dio un uso industrial. Tras mejorar el proceso de síntesis, propone su uso como refrigerante.
Midgley regresa ante el público para demostrar que este gas se puede respirar sin problema y no es inflamable. Lo inhala y luego lo sopla hacia una vela, permaneciendo el gas inerte. Por fin las neveras ya no son un riesgo.
Los CFC son un éxito inmediato. Se comienzan a utilizar no sólo en refrigeradores, también en aerosoles y en disolventes. Son seguros. O al menos lo eran a corto plazo y a nivel del suelo… La situación cambiaba a grandes alturas.
En las condiciones donde se utilizaban, los CFC no reaccionaban con nada. Después de su uso, eran liberados a la atmósfera y ascendían hasta la estratosfera, concretamente a la capa de ozono, presente entre 15 y 50 km de altitud.
La ozonosfera es vital para la vida en la Tierra. Reúne el 90% del ozono del planeta y absorbe hasta el 99% de los rayos ultravioletas más energéticos (y más peligrosos para nosotros). Sin ella, nuestro hogar sería un lugar mucho más desagradable.
El ozono está compuesto por tres átomos de oxígeno y se forma gracias a la descomposición de una molécula de oxígeno mediante fotones muy energéticos. Luego uno de esos átomos se combina con otra molécula y finalmente da lugar al ozono. 

Pero, ¿qué ocurre si hay otro compuesto en mitad del proceso? ¿Qué pasa con los CFC? Al igual que el oxígeno, los CFC se pueden descomponer si son “golpeados” con fotones muy energéticos. En este caso, la molécula pierde uno de los átomos de cloro.
Lo malo es que el cloro libre es extremadamente reactivo, es decir, le gusta mucho juntarse con otros átomos. El ozono es un candidato perfecto para ello. El cloro rompe la molécula y de la reacción surge oxígeno diatómico y monóxido de cloro.
Luego, este monóxido de cloro se rompe al interaccionar con la molécula de oxígeno, generando, de nuevo, un átomo de cloro para romper más ozono. Un ciclo realmente peligroso, tanto para el planeta como para todos los seres vivos que lo pueblan. 

Afortunadamente, en la década de los 80, se descubrió una disminución del 50% del ozono en el Polo Sur, el denominado agujero de la capa de ozono. Tras varias investigaciones, se encontró al culpable, los CFC. 
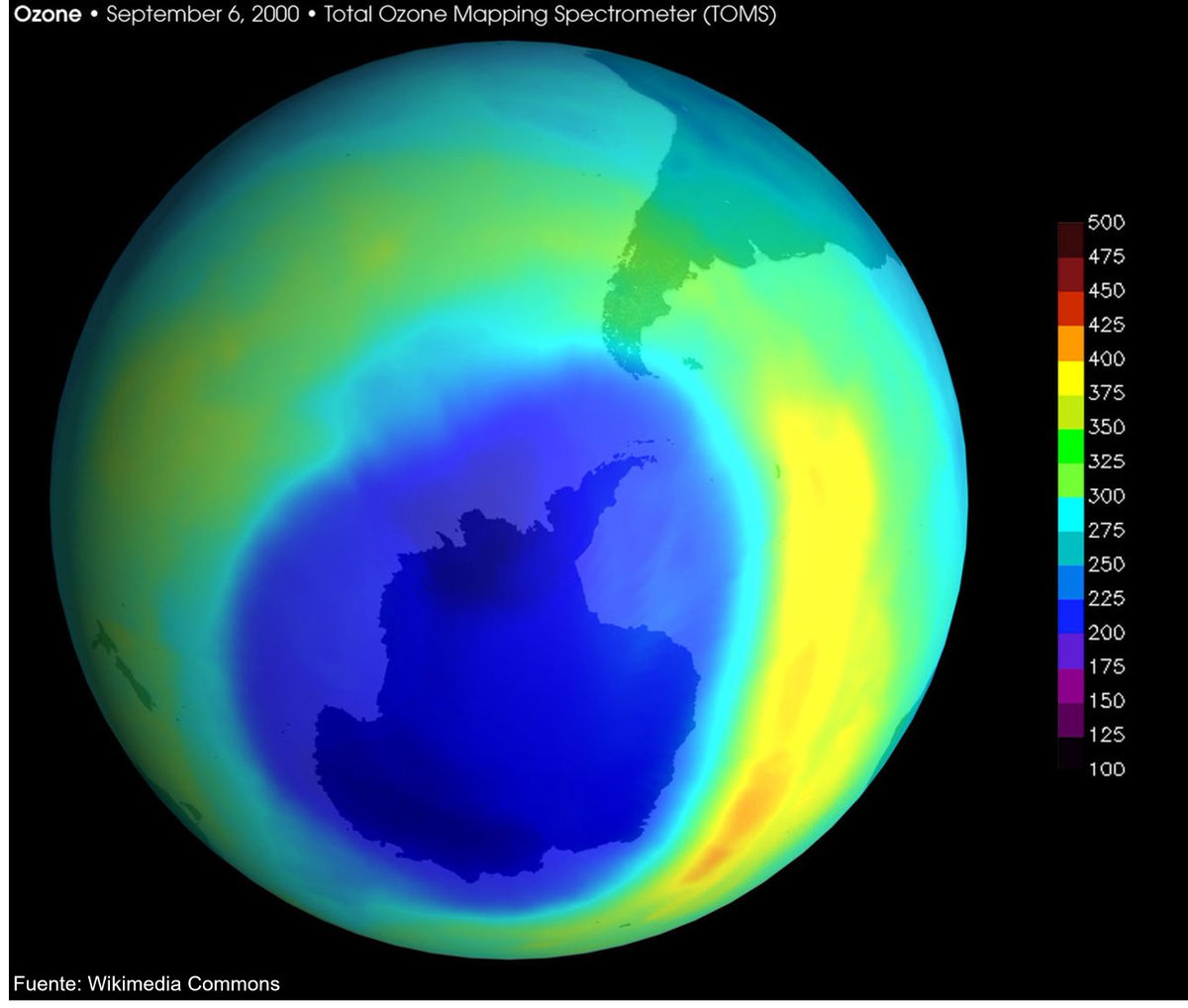
Así, en 1987 y con un acuerdo internacional, se puso en marcha el Protocolo de Montreal, con el objetivo de reducir la producción de CFC en un 50% para 1997. Estos gases cada vez están menos presentes, pero sus efectos siguen ahí. El agujero no desaparecerá antes de 2075…
Midgley nunca se enteró del problema que había causado con este gas (del plomo sí era consciente). Falleció en 1944 con tan sólo 55 años de la manera más insólita, muerto por su propia invención. Y no, no estoy hablando ni de la gasolina con plomo ni de los CFC.
En 1940 contrajo la polio, lo que le provocó una parálisis parcial. No era capaz de mover las piernas, así que empezó a utilizar silla de ruedas. Con la idea de ser lo más autónomo posible, diseñó un sistema de poleas que le ayudaban a desplazarse de la cama a la silla.
Cuatro años después, ocurrió el trágico accidente. Se encontraba solo en casa y puso en marcha el sistema. Sin embargo, algo falló, quedando enredado en las cuerdas y muriendo estrangulado.
Sus inventos le otorgaron varios premios en vida, pero con los años se ha convertido en una personalidad controvertida. Por un lado, los CFC. No se conocían sus efectos en la atmósfera y la aplicación en las neveras probablemente salvaron muchas vidas.
Y por el otro, la gasolina con plomo. Una sustancia que provocó multitud de problemas de salud y cuya peligrosidad era sumamente conocida. Las campañas de marketing para ocultarlo fueron sin duda deleznables…
Pero una cosa es clara, en palabras del historiador John McNeill, “tuvo más impacto en la atmósfera que cualquier otro organismo en la historia de la Tierra”. Su nombre estará siempre asociado a la causa medioambiental (y no precisamente para bien).
Y hasta aquí todo por hoy. Muchas gracias por leerme. Como siempre, cualquier RT, MG, duda o comentario es bienvenido! Nos vemos pronto con más ciencia. No duden en pasarse por #hilosdc7. Qué nivel!
Aquellas imágenes y gifs en las que no se indique la fuente proceden de Wikimedia Commons. Si quieres leer más sobre el tema, dejo por aquí los enlaces:
bbvaopenmind.com/ciencia/invest…
culturacientifica.com/2014/03/24/el-…
es.wikipedia.org/wiki/Tetraetil…
atsdr.cdc.gov/es/phs/es_phs1…
prtr-es.es/CFC-clorofluor…
bbvaopenmind.com/ciencia/invest…
culturacientifica.com/2014/03/24/el-…
es.wikipedia.org/wiki/Tetraetil…
atsdr.cdc.gov/es/phs/es_phs1…
prtr-es.es/CFC-clorofluor…
• • •
Missing some Tweet in this thread? You can try to
force a refresh