#Molnupiravir desarrollado por #Merck y Ridgeback Biotherapeutics podría ser la 1a droga antiviral oral a nivel mundial contra #COVID19
Ha sido aprovado hoy en #ReinoUnido por la Medicines and Healthcare products Regulatory Agency (MHRA) con el nombre comercial de Lagevrio
Hilo
Ha sido aprovado hoy en #ReinoUnido por la Medicines and Healthcare products Regulatory Agency (MHRA) con el nombre comercial de Lagevrio
Hilo

#Molnupiravir es un antiviral de amplio espectro desarrollado por casi 10 años. Se usó por 1a vez como fármaco contra el ébola en Liberia (2016-2017). Otras terapias vs #COVID19:
#Remdesivir (Gilead Science) y cóctel de anticuerpos monoclonales (Regeneron) vía IV o inyección.
#Remdesivir (Gilead Science) y cóctel de anticuerpos monoclonales (Regeneron) vía IV o inyección.

#Molnupiravir (MK-4482 / EIDD-2801) es una forma experimental de un potente análogo de ribonucleósido que inhibe la replicación del #SARSCoV2
Es activo en varios modelos preclínicos de SARS-CoV-2, incluso para la profilaxis, el tratamiento y la prevención de la transmisión.
Es activo en varios modelos preclínicos de SARS-CoV-2, incluso para la profilaxis, el tratamiento y la prevención de la transmisión.
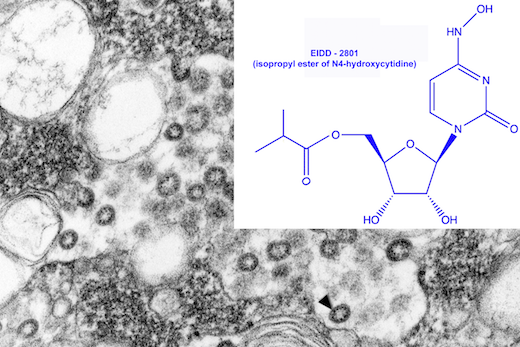
El molnupiravir se inventó en Drug Innovations at Emory (DRIVE), LLC, una empresa de biotecnología sin fines de lucro de propiedad total de Emory University. 

En el análisis intermedio, molnupiravir ↓ riesgo de hospitalización/muerte casi un 50% (1550 pacientes)
7.3% de pacientes tratados c/molnupiravir fueron hospitalizados/murieron hasta el día 29, aleatorización (28/385) vs 14.1% de pacientes del grupo placebo (53/377)
p = 0,0012
7.3% de pacientes tratados c/molnupiravir fueron hospitalizados/murieron hasta el día 29, aleatorización (28/385) vs 14.1% de pacientes del grupo placebo (53/377)
p = 0,0012

Hasta el día 29, cero muertes en pacientes con #molnupiravir vs 8 muertes en pacientes del grupo placebo. Un Comité de Monitoreo de Datos independiente, en consulta con la FDA, recomendó detener anticipadamente el reclutamiento para el estudio dados los resultados positivos FASE3 

Ensayo MOVe-OUT (MK-4482-002)
(NCT04575597)
Estudio global Fase 3
Aleatorizado
Controlado c/placebo
Doble ciego (múltiples sitios)
Elegibilidad:
Pacientes #COVID19 leve a moderado confirmado x lab
Síntomas 1eros 5 días post a aleatorización
1 factor de riesgo asociado c/resultado
(NCT04575597)
Estudio global Fase 3
Aleatorizado
Controlado c/placebo
Doble ciego (múltiples sitios)
Elegibilidad:
Pacientes #COVID19 leve a moderado confirmado x lab
Síntomas 1eros 5 días post a aleatorización
1 factor de riesgo asociado c/resultado

Fase 3 del ensayo se llevó a cabo en más de 170 sitios planificados:
Argentina
Brasil
Canadá
Chile
Colombia
Egipto
Francia
Alemania
Guatemala
Israel
Italia
Japón
México
Filipinas
Polonia
Rusia
Sudáfrica
España
Suecia
Taiwán
Ucrania
Reino Unido
EEUU
Clinicaltrials.gov
Argentina
Brasil
Canadá
Chile
Colombia
Egipto
Francia
Alemania
Guatemala
Israel
Italia
Japón
México
Filipinas
Polonia
Rusia
Sudáfrica
España
Suecia
Taiwán
Ucrania
Reino Unido
EEUU
Clinicaltrials.gov
La eficacia no se vio afectada por el momento de aparición de los síntomas o el factor de riesgo subyacente. Según los participantes con datos de secuenciación viral disponibles (40%), #molnupiravir demostró una eficacia constante en variantes Gamma, Delta y Mu. 

Incidencia de efecto adverso fue comparable en los grupos #molnupiravir y placebo (35% y 40%)
Incidencia de eventos adversos relacionados con el fármaco también fue comparable (12% y 11%)
Interrumpieron la terapia debido a evento adverso: #molnupiravir 1,3% vs grupo placebo 3,4%.
Incidencia de eventos adversos relacionados con el fármaco también fue comparable (12% y 11%)
Interrumpieron la terapia debido a evento adverso: #molnupiravir 1,3% vs grupo placebo 3,4%.

El gobierno de USA hará que éste medicamento, así como los anticuerpos monoclonales, sean gratis como parte de la respuesta pandémica.
Otro antiviral, un inhibidor de la proteasa de #Pfizer en ensayos clínicos, que debería completarse a fines de este año o principios del próximo.
Otro antiviral, un inhibidor de la proteasa de #Pfizer en ensayos clínicos, que debería completarse a fines de este año o principios del próximo.

• • •
Missing some Tweet in this thread? You can try to
force a refresh







