
@anvisa_oficial , agora na @GloboNews , anuncia:
1) Registro da vacina da AstraZeneca/Oxford (já estava em aprov. uso emergencial) com etapa de fabricação no Brasil -> Maior autonomia e acesso a vacina
2) 1º registro de medicamento com indicação contra a COVID-19 (Remdesivir)
1) Registro da vacina da AstraZeneca/Oxford (já estava em aprov. uso emergencial) com etapa de fabricação no Brasil -> Maior autonomia e acesso a vacina
2) 1º registro de medicamento com indicação contra a COVID-19 (Remdesivir)
- A @anvisa_oficial destaca que não recebeu pedido de autorização de importação/uso emergencial/registro por parte da Moderna
- Sobre a Sputnik-V: pedido para realizar estudo clínico no Brasil (exigências ainda não respondidas) e o pedido pra uso emergencial foi devolvido
- Sobre a Sputnik-V: pedido para realizar estudo clínico no Brasil (exigências ainda não respondidas) e o pedido pra uso emergencial foi devolvido
Foi solicitado dados das investigações e está no aguardo deles para proceder com a análise
- Sobre a COVAXIN: destaca que não recebeu pedido de autorização uso emergencial. Reunião no dia 15 pode delinear melhor as estratégias.
- Sobre a COVAXIN: destaca que não recebeu pedido de autorização uso emergencial. Reunião no dia 15 pode delinear melhor as estratégias.
A empresa sinalizou que há interesse de fazer estudo clínico aqui no BR junto do Hospital Albert Einstein. Semana passada foi concluída a inspeção de verificação da empresa que fabrica a vacina. Resultados devem sair em breve
- Outras vacinas estão sendo consideradas para realização de estudos clínicos aqui no Brasil e mais dados estão sendo aguardados para poder dar seguimento à formalização dos pedidos e análises
- Sobre a Cansino: resultados promissores e já conversando com a empresa para delienar estratégias com o Brasil
- Iniciativas de univerisdades brasileiras: @anvisa_oficial está acompanhando e dando todo o aconselhamento científico para avanços das fases clínicas (UFMG, UFRJ, Ribeirão Preto)
SOBRE OS REGISTROS CONCEDIDOS HOJE:
Linha de tempo da análise e pedidos de aprovação emergencial e registro definitivo da vacina da AstraZeneca/Oxford
Linha de tempo da análise e pedidos de aprovação emergencial e registro definitivo da vacina da AstraZeneca/Oxford
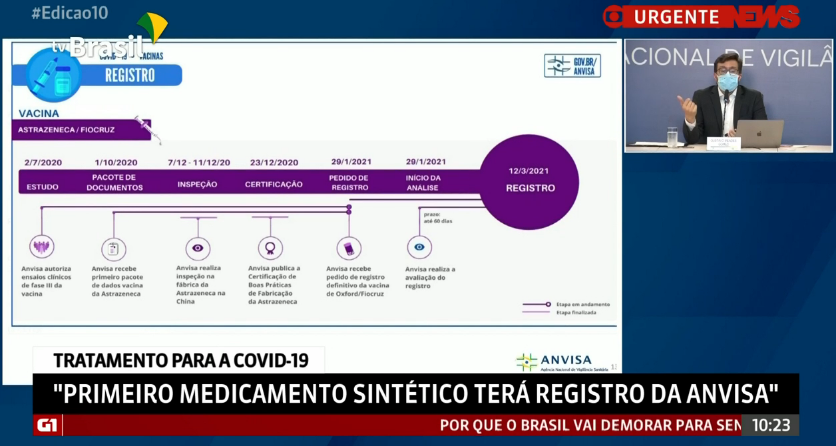
Atualmente, o IFA é produzido pela WuXi Biologics e a FIOCRUZ gera o produto final para a aplicação. 

@anvisa_oficial avaliou diferentes fatores que viabilizam a produção do IFA (imagem abaixo), bem como dados já obtidos frutos dos ensaios clínicos: 







Após a análise dos dados, a @anvisa_oficial dá suporte para o registro definitivo da vacina aqui no Brasil e mais dados serão enviados continuamente para a Anvisa para esse monitoramento seguir. 



A Anvisa também pediu, via plano de monitoramento, mais dados sobre as variantes emergentes, como a P.1, e o impacto delas sobre a vacina. Os dados devem vir nos próximos meses.
Após a inspeção e aprovação da Wuxi Biologics Co. + o cumprimento de boas práticas de fabricação pela Fiocruz, o registro é indicado por parte da Agência 

SOBRE O REMDESIVIR:
Primeiro medicamento aprovado pela Agência com indicação para a COVID-19, segundo a @anvisa_oficial
Sobre a fabricação: envolve 6 fábricas (5 nos EUA e 1 na Irlanda), cada uma com autorização para realizar determinadas etapas de fabricação


Primeiro medicamento aprovado pela Agência com indicação para a COVID-19, segundo a @anvisa_oficial
Sobre a fabricação: envolve 6 fábricas (5 nos EUA e 1 na Irlanda), cada uma com autorização para realizar determinadas etapas de fabricação



Sobre segurança e eficácia:
- indicado para tratamento de COVID-19 para pacientes acima de 12 anos, acima de 40 kg, QUE ESTEJAM COM pneumonia e requerem administração suplementar de Oxigênio
- indicado para tratamento de COVID-19 para pacientes acima de 12 anos, acima de 40 kg, QUE ESTEJAM COM pneumonia e requerem administração suplementar de Oxigênio
- A indicação está ligada pela apresentação da pneumonia com necessidade de Oxigênio DESDE que o paciente não esteja com ventilação mecânica ou em ECMO
- O tratamento deve ser feito por, no mínimo, 5 dias e, no máximo, 10 dias
- O tratamento deve ser feito por, no mínimo, 5 dias e, no máximo, 10 dias
Ou seja, a indicação é para um cenário BEM específico, num quadro que a pessoa apresente pneumonia e precise de suplementação de oxigenio (que é diferente de ventilação mecânica e ECMO).
Essa é a indicação. Qualquer outra, não tem indicação.
Essa é a indicação. Qualquer outra, não tem indicação.
- Segundo a @anvisa_oficial o remdesivir foi aprovado pelo FDA, EMA, Health Canada, Suiça, Austrália e outros países.
Sobre estudos pré-clínicos:
Sobre estudos pré-clínicos:

Estudos clínicos: pacientes que receberam o remdesivir tiveram um tempo menor de recuperação.
Pelo que estou entendendo, os dados apresentados são dessa publicação da @NEJM nejm.org/doi/full/10.10…



Pelo que estou entendendo, os dados apresentados são dessa publicação da @NEJM nejm.org/doi/full/10.10…




O Remdesivir foi bem tolerado e a maioria dos eventos adversos estão mais relacinados a manifestações de COVID-19 do que a terapia com o Remdesivir 

A Agência ressalta a consulta da indicação na bula, que deve ser obedecida, uma vez que os dados analisados são frutos de estudo em contextos específicos de COVID-19.
Não deve ser usado para outro fim ou outros contextos sem dados e aprovação da agência
Conclusões:
Não deve ser usado para outro fim ou outros contextos sem dados e aprovação da agência
Conclusões:

@threadreaderapp compile
@oatila @schrarstzhaupt @MarceloBragatte @PauloLotufo @MBittencourtMD @parolin_ricardo @otavio_ranzani @ThomasVConti @luizacaires3 @izabellapena1 @UPVacina @obscovid19br @ntsnaleatorias @BlogsUnicamp @analise_covid19 @grupo_infovid @laribrussa
@oatila @schrarstzhaupt @MarceloBragatte @PauloLotufo @MBittencourtMD @parolin_ricardo @otavio_ranzani @ThomasVConti @luizacaires3 @izabellapena1 @UPVacina @obscovid19br @ntsnaleatorias @BlogsUnicamp @analise_covid19 @grupo_infovid @laribrussa
@beatrizjuca @Talitaduvanel @andre_biernath @ananias_1979 @mab_sp125 @josegallucci @leticiakawano @dadourado
Lembrando que o dado do Remdesivir é
- indicado especificamente para um contexto (pacientes GRAVES de COVID-19, COM pneumonia, COM suplementação de O2 que NÃO ESTEJAM entubados ou em ECMO).
- Bem tolerado e mostrou efeitos benéficos NO CONTEXTO ACIMA.
- indicado especificamente para um contexto (pacientes GRAVES de COVID-19, COM pneumonia, COM suplementação de O2 que NÃO ESTEJAM entubados ou em ECMO).
- Bem tolerado e mostrou efeitos benéficos NO CONTEXTO ACIMA.
Roberto Medronho, agora na @GloboNews , faz comentários bem pertinentes sobre. Um estudo multicêntrico que será publicado por volta de Maio nos trará mais dados sobre outros subgrupos que estão sendo analisados. Por hora, a indicação é para apenas o subgrupo acima citado
O medicamento é caro, para uso injetável. Medronho comenta que precisamos analisar se o custo de aquisição dele será menor que os beneficios que o medicamento traz, se o SUS terá capacidade de absorvê-lo
Remdesivir NÃO SUBSTITUI:
- Vacina
- Medidas de enfrentamento (uso de máscara, evitar aglomeração, fazer distanciamento físico, higienização)
O que ele faz:
- Auxilia no tratamento de casos graves de COVID-19 COM pneumonia, COM suplementação de O2 SEM entubação ou ECMO
- Vacina
- Medidas de enfrentamento (uso de máscara, evitar aglomeração, fazer distanciamento físico, higienização)
O que ele faz:
- Auxilia no tratamento de casos graves de COVID-19 COM pneumonia, COM suplementação de O2 SEM entubação ou ECMO
• • •
Missing some Tweet in this thread? You can try to
force a refresh


