Excelente fio do @pedrocintra52 sobre os resultados de fase 3 da vacina da @CloverBiopharma (vacina de subunidade de proteína)
As eficácias contra as variantes específicas foram:
#Gamma 91.8%
#Delta 78.7%
#Mu 58.6%
Comentários abaixo 👇
As eficácias contra as variantes específicas foram:
#Gamma 91.8%
#Delta 78.7%
#Mu 58.6%
Comentários abaixo 👇
https://twitter.com/pedrocintra52/status/1440732518802542604
Em abril, tivemos a aprovação pela @anvisa_oficial do início dos estudos aqui no Brasil!
A fase 2/3 contou com 30.000 participantes acima de 18 anos de 5 países diferentes, como Colômbia 🇨🇴, Filipinas 🇵🇭, Brasil 🇧🇷, África do Sul🇿🇦 e Bélgica🇧🇪

A fase 2/3 contou com 30.000 participantes acima de 18 anos de 5 países diferentes, como Colômbia 🇨🇴, Filipinas 🇵🇭, Brasil 🇧🇷, África do Sul🇿🇦 e Bélgica🇧🇪
https://twitter.com/mellziland/status/1384553208371159051

Desses ~30 mil participantes, metade recebeu a vacina e metade recebeu um placebo
O regime é de duas doses, intervaladas por 21 dias
No Brasil🇧🇷, cerca de 8 mil indivíduos participaram do estudo
O regime é de duas doses, intervaladas por 21 dias
No Brasil🇧🇷, cerca de 8 mil indivíduos participaram do estudo

A apresentação traz um ponto interessante em relação a essa vacina por ter sido estudada num período de predominância da #Delta. E é importante relembrar que, as vacinas já aprovadas tem efetividade demonstrada contra essa variante. :) 
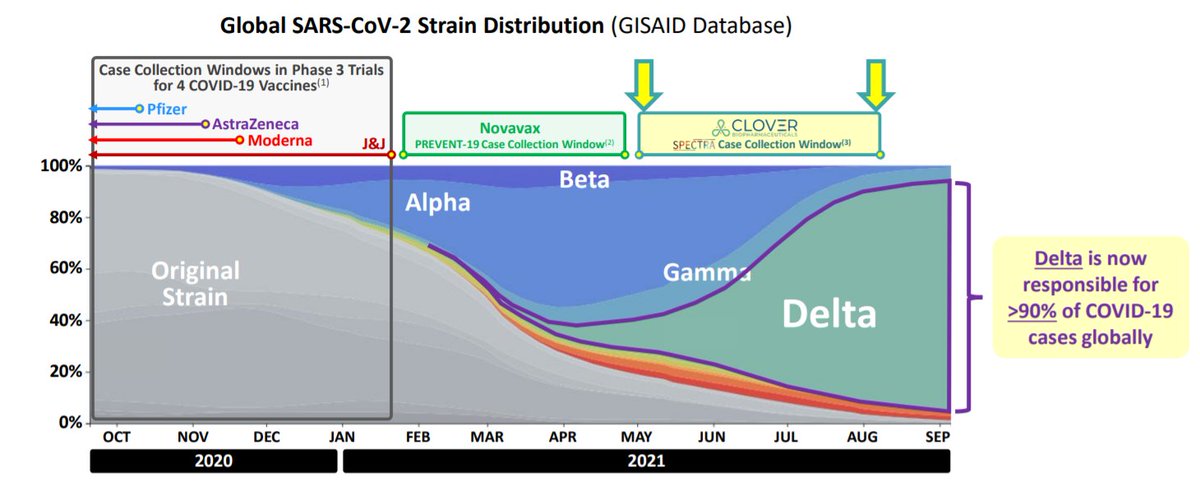
A maior parte das variantes detectadas enquanto o estudo era realizado eram #Delta #Mu e #Gama seguido por outras, como é mostrado abaixo 

É importante destacar que o número de casos obtidos apresentados é bastante baixo, e precisa de uma maior complementação, mas dentre os casos observados, a vacina preveniu substancialmente COVID-19 severa e hospitalização cloverbiopharma.com/upload/pdf/SPE…
As eficácias contra as variantes específicas foram:
#Gamma 91.8%
#Delta 78.7%
#Mu 58.6%
Além disso, o documento destaca um perfil de segurança positivo, com eventos autolimitados, leves-moderados de rápida resolução
#Gamma 91.8%
#Delta 78.7%
#Mu 58.6%
Além disso, o documento destaca um perfil de segurança positivo, com eventos autolimitados, leves-moderados de rápida resolução

Legal destacar que temos outra vacina de subunidade de proteína já aprovada em alguns locais, que é a Novavax, abaixo meu fio comentando os dados de fase 3
https://twitter.com/mellziland/status/1410405506536120325
Essas vacinas de subunidade são bem interessantes e versáteis. Proteínas são mais estáveis e o armazenamento não tende a ser complicado como vimos pra outros imunizantes. Além disso, o custo pode ser menor também.
Além disso, daqui a pouco pode também ser uma boa alternativa de combinação heteróloga com outras vacinas. Por isso é bacana termos diferentes tecnologias, pois assim podemos ter mais flexibilidade de seguir ampliando o programa de vacinação em massa
Vamos aguardar o artigo/preprint como o querido @otavio_ranzani bem disse. Mas enfim, boa notícia é boa notícia né pessoal!
Uma notícia interessante também é que a Novavax planeja distribuir 2 bi de doses da sua 💉em 2022 reuters.com/business/healt…
Uma notícia interessante também é que a Novavax planeja distribuir 2 bi de doses da sua 💉em 2022 reuters.com/business/healt…
Link dos dados apresentados da Clover: cloverbiopharma.com/upload/pdf/SPE…
• • •
Missing some Tweet in this thread? You can try to
force a refresh