Pharmakologische Unterbrechung der Aktivität des mSWI/SNF-Komplexes beschränkt die #SARSCoV2-Infektion
Diese neue Studie zeigt die potenzielle prophylaktische und therapeutische Wirkung von mSWI/SNF-Inhibitoren für aktuelle und neu auftretende #Coronaviren.
#COVID19 #Covid_19
Diese neue Studie zeigt die potenzielle prophylaktische und therapeutische Wirkung von mSWI/SNF-Inhibitoren für aktuelle und neu auftretende #Coronaviren.
#COVID19 #Covid_19

Der mSWI/SNF-Komplex ist eine Gruppe von Proteinen, die in unseren Zellen vorkommen und für die Regulation der Genexpression wichtig sind. Der Name "mSWI/SNF" steht für "mammalian Switch/Sucrose Non-Fermentable", was auf die ursprünglichen Entdeckungen des Komplexes in Hefe und 
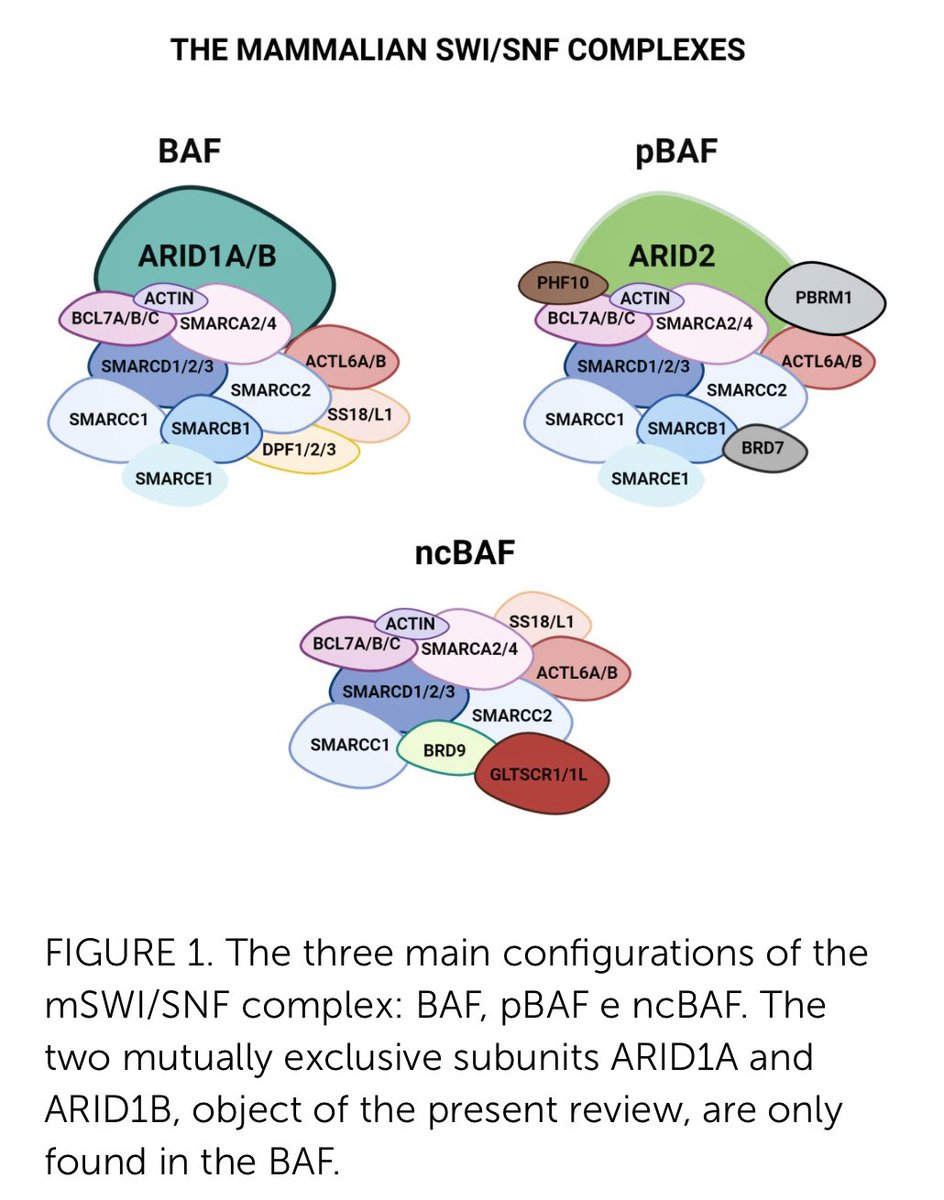
Drosophila (Fruchtfliege) zurückgeht.
Der mSWI/SNF-Komplex ist Teil eines größeren Netzwerks von Proteinen, das dafür sorgt, dass bestimmte Gene aktiviert oder deaktiviert werden können. Das ist wichtig, da jede Zelle im Körper dieselben Gene besitzt, aber nur bestimmte Gene in
Der mSWI/SNF-Komplex ist Teil eines größeren Netzwerks von Proteinen, das dafür sorgt, dass bestimmte Gene aktiviert oder deaktiviert werden können. Das ist wichtig, da jede Zelle im Körper dieselben Gene besitzt, aber nur bestimmte Gene in
einer bestimmten Zelle aktiv sein sollten. Der mSWI/SNF-Komplex wirkt dabei wie ein "Schalter", der die Chromatinstruktur - Chromatin wird das Material genannt, aus dem die Chromosomen aufgebaut sind, es besteht zum größten Teil aus DNA und verschiedenen Proteinen, die als 
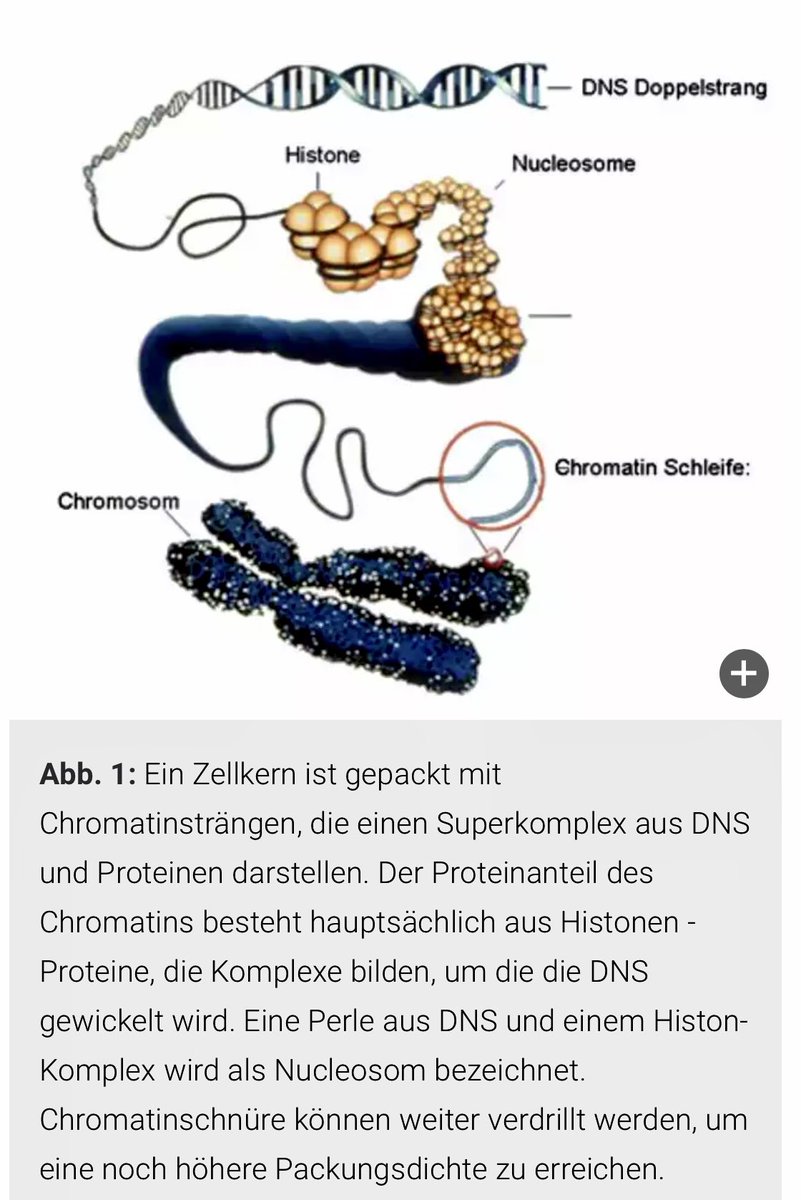
Histone bezeichnet werden - verändert und dadurch die Zugänglichkeit bestimmter Gene für die zellulären Maschinerien erhöht oder reduziert. Dies geschieht durch Veränderungen der Struktur von Histonen und DNA. Durch diese Veränderungen können Gene für die Transkription freigelegt 

werden oder eben nicht.
Insgesamt ist der mSWI/SNF-Komplex also ein wichtiger Regulator für die Genexpression und somit für die korrekte Entwicklung und Funktion von Zellen und Organismen.
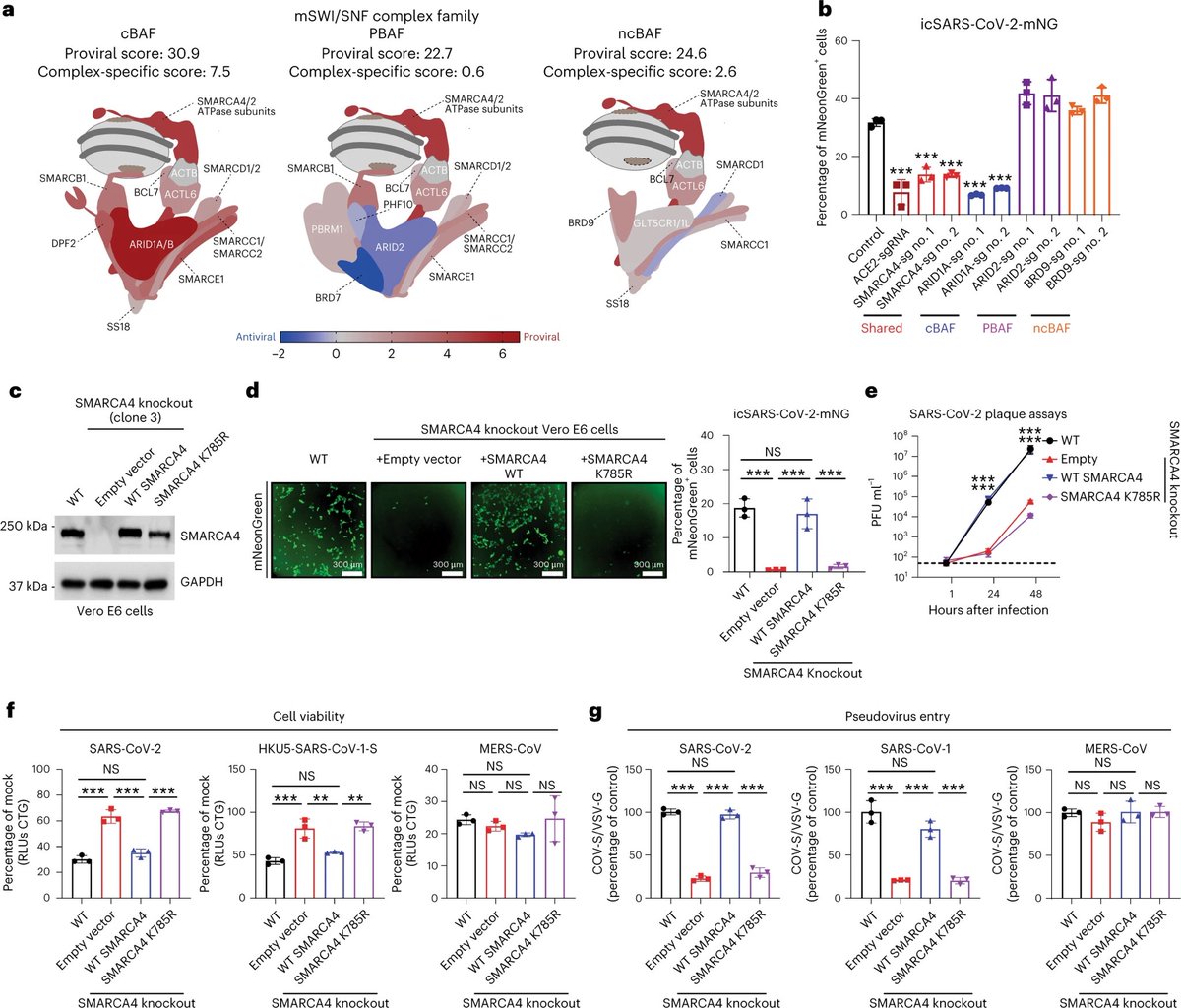
Diese Studie zeigt, dass der mSWI/SNF Komplex und insbesondere der kanonische
Insgesamt ist der mSWI/SNF-Komplex also ein wichtiger Regulator für die Genexpression und somit für die korrekte Entwicklung und Funktion von Zellen und Organismen.
Diese Studie zeigt, dass der mSWI/SNF Komplex und insbesondere der kanonische
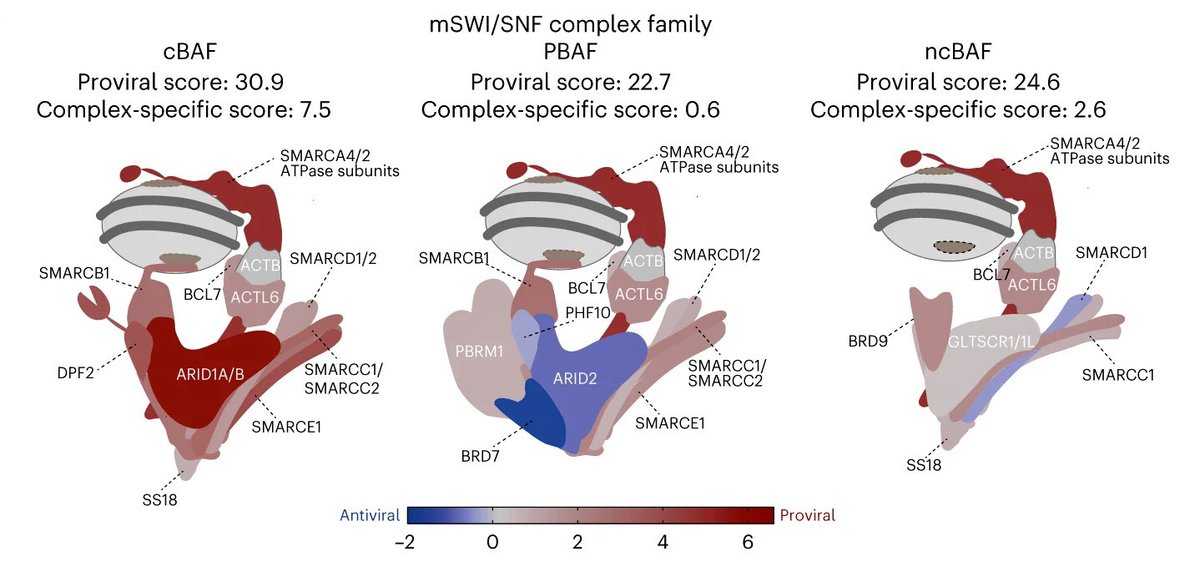
BRG1/BRM-assoziierte Faktor (cBAF)-Komplex, das Eindringen des SARS-CoV-2 Virus in die Zellen erleichtern kann. Der cBAF-Komplex hilft dabei, Gene in unseren Zellen zu aktivieren oder zu deaktivieren, indem er sich an bestimmte Stellen auf der DNA bindet und sie zugänglicher oder 

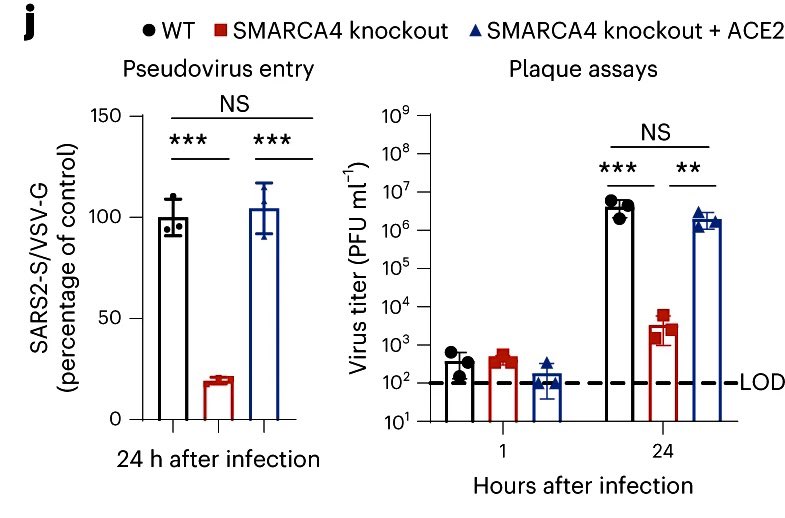
unzugänglicher macht. Die Aktivität dieser Proteine fördert die Infektion mit dem Virus und macht die Zellen anfälliger für das Virus. Für die Produktion des Proteins BRG1 kodiert das Gen SMARCA4. Die katalytische Aktivität von SMARCA4 ist für die mSWI/SNF-gesteuerte Chromatin- 
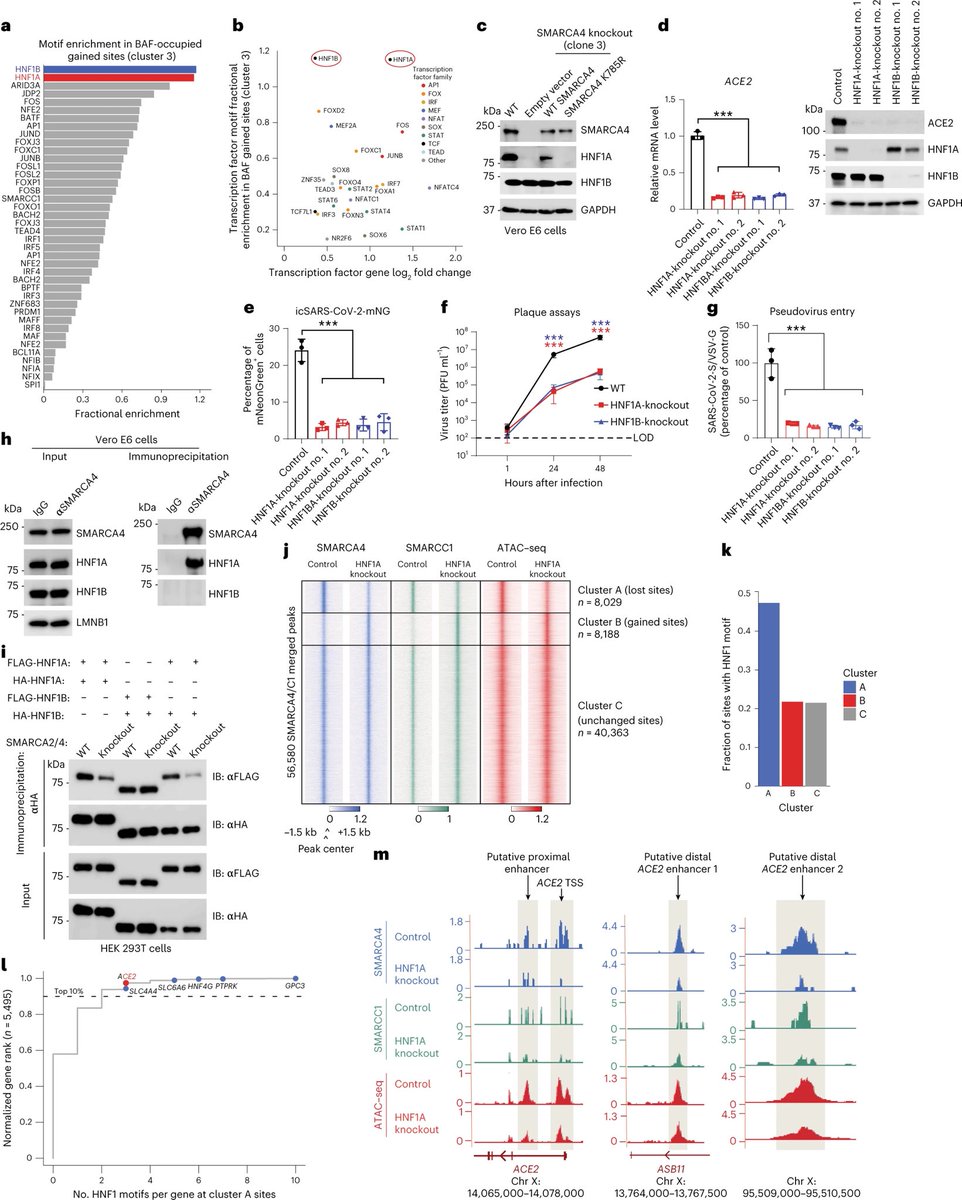
Zugänglichkeit am ACE2-Lokus (ein Gen auf dem menschlichen X-Chromosom, dass für für das Enzym Angiotensin Converting Enzyme 2 - ACE2 - kodiert), die ACE2-Expression und die Virusanfälligkeit erforderlich. Die Transkriptionsfaktoren HNF1A/B interagieren mit mSWI/SNF-Komplexen und 
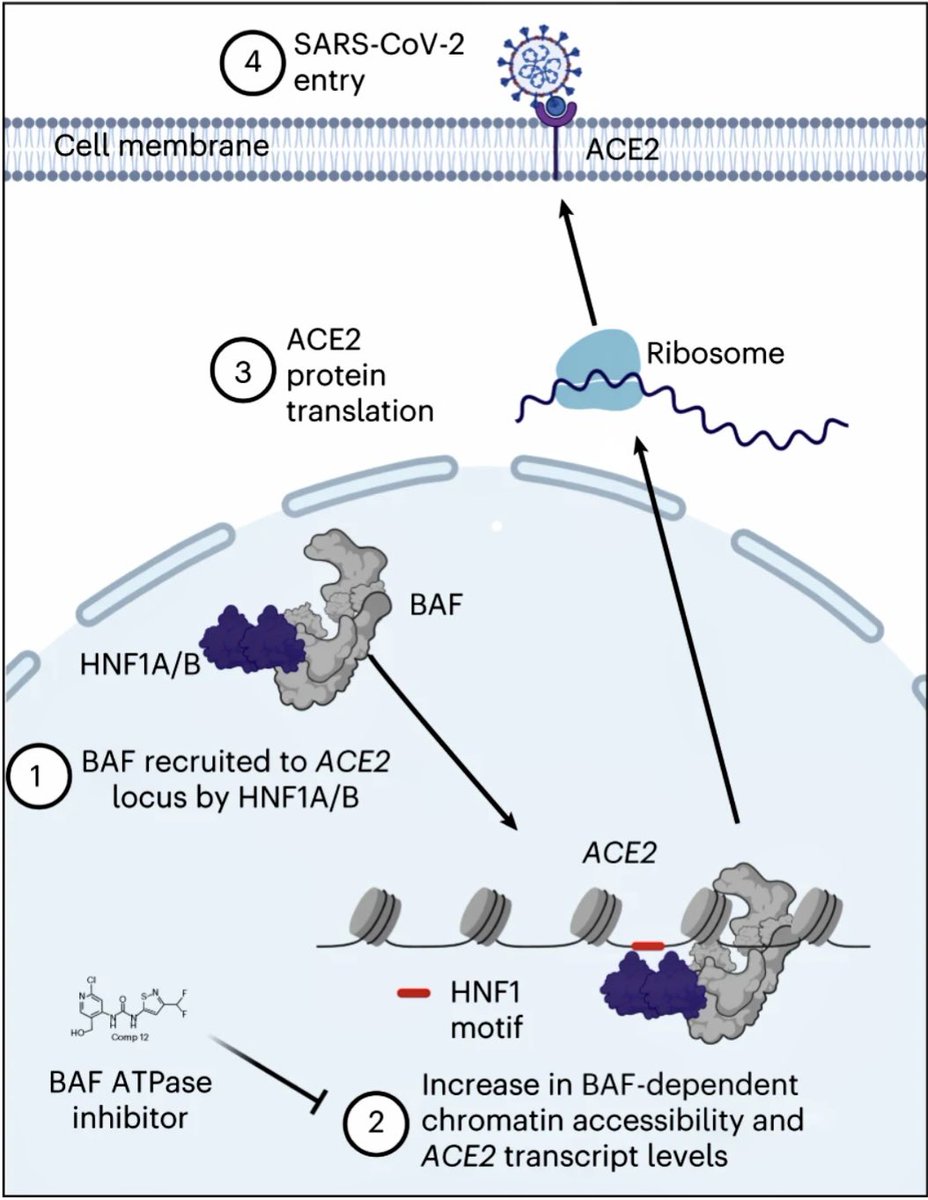
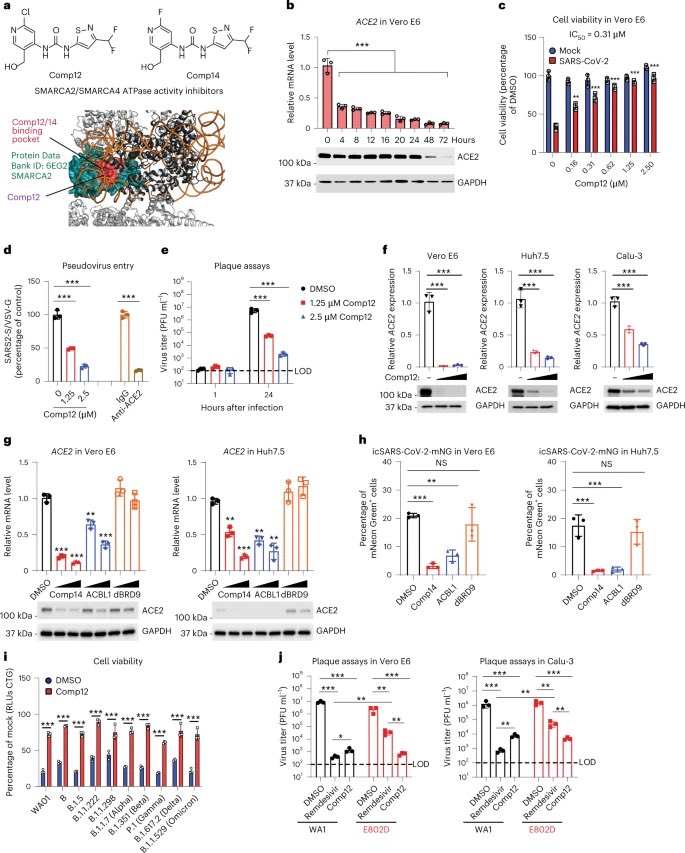
rekrutieren diese an ACE2-Enhancer, die eine hohe HNF1A-Motivdichte aufweisen. Insbesondere hemmen niedermolekulare mSWI/SNF-ATPase-Inhibitoren oder Degrader die Expression des Angiotensin-umwandelnden Enzyms 2 (ACE2) und verleihen drei Zelllinien und drei primären menschlichen 
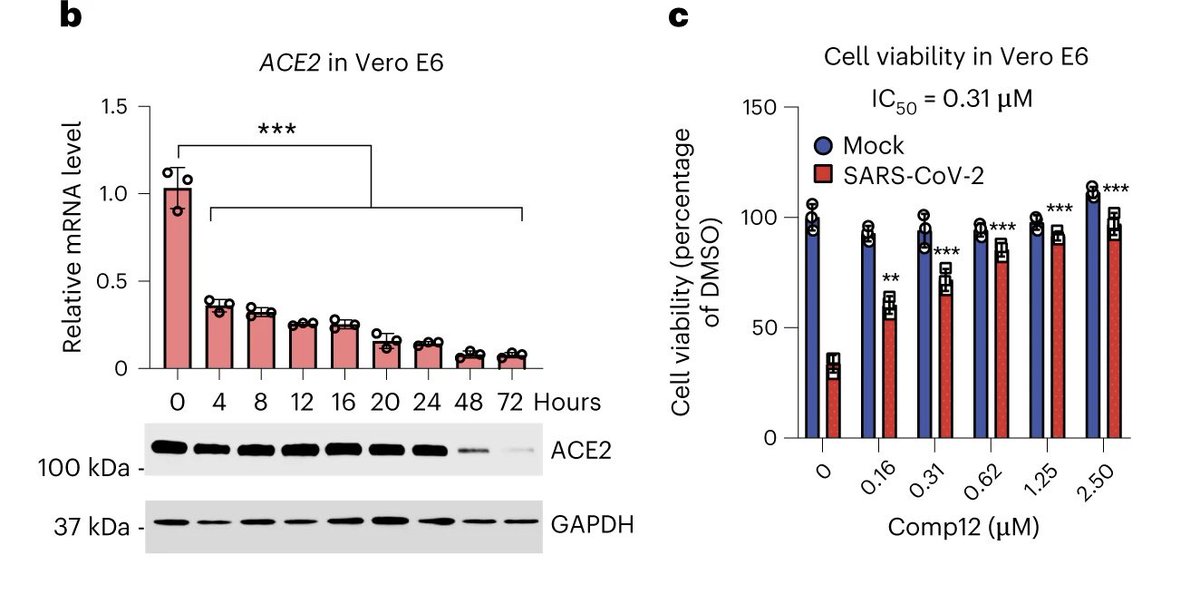
Zelltypen, einschließlich Epithelzellen der Atemwege, eine Resistenz gegen SARS-CoV-2-Varianten und ein Remdesivir-resistentes Virus um bis zu 5 logs (also um bis zu 99,999%). Diese Daten unterstreichen die Rolle der Aktivitäten des mSWI/SNF-Komplexes bei der Verleihung der 

SARS-CoV-2-Anfälligkeit und identifizieren eine potenzielle Klasse von breit wirkenden Virostatika zur Bekämpfung neu auftretender Coronaviren. SMARCA2/4-ATPase-Antagonisten befinden sich derzeit in klinischen Studien der Phase I für SMARCA2/4-abhängige Krebsarten wie 
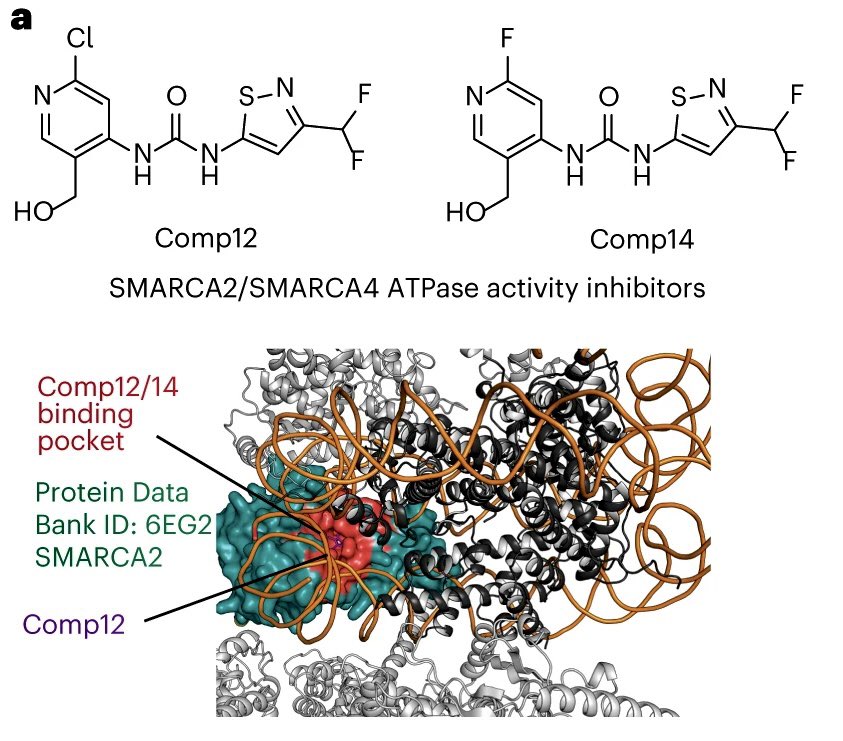
Aderhautmelanom und akute myeloische Leukämie, was die Realisierbarkeit dieses Ansatzes hervorhebt.
Der Abzielen auf mSWI/SNF-Komplexe bietet mehrere potenzielle Vorteile bei der Regulierung der ACE2-Expression und der Virus-Infektion. Erstens ist angesichts des
Der Abzielen auf mSWI/SNF-Komplexe bietet mehrere potenzielle Vorteile bei der Regulierung der ACE2-Expression und der Virus-Infektion. Erstens ist angesichts des
Mechanismus der mSWI/SNF-Komplexe bei der Regulierung der genomischen Zugänglichkeit in der Wirtszelle davon auszugehen, dass der virale Antagonismus synergistisch mit bestehenden, direkt wirkenden antiviralen und immunmodulatorischen Medikamenten des Wirts wirkt. Zweitens können 
SMARCA4-Inhibitoren durch die Herabregulierung von ACE2 verschiedene ACE2-verwertende Viren hemmen, darunter HCoV-NL63, SARS-CoV-1, SARS-CoV-2-Varianten, einschließlich Remdesivir-resistenter Formen, und kürzlich in Fledermäusen entdeckte Sarbecoviren, die ein erhebliches Risiko 
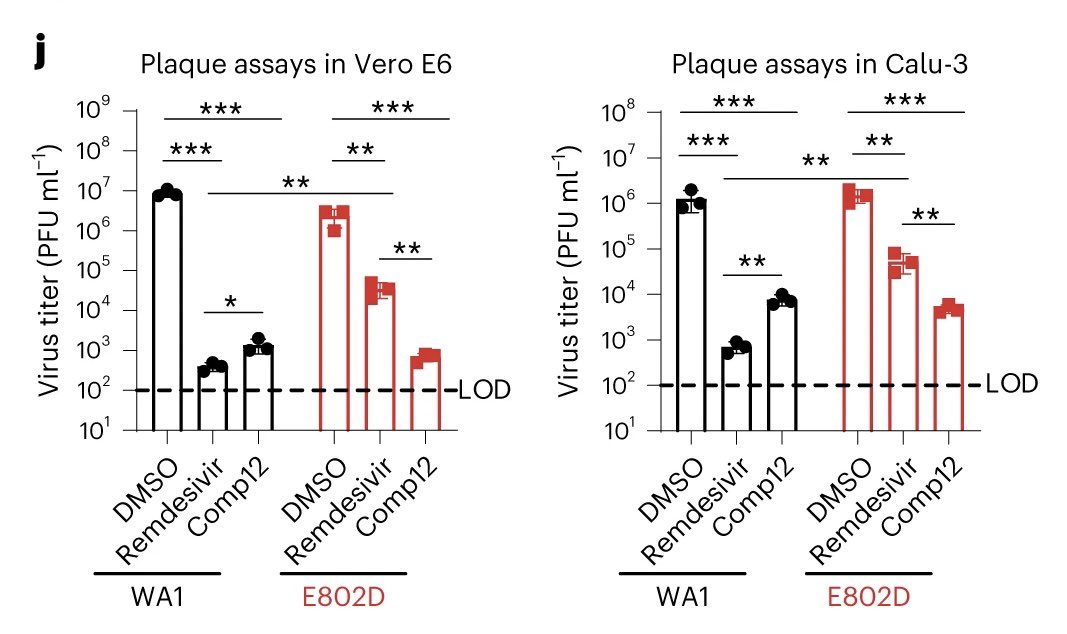
für die Entstehung künftiger Pandemien beim Menschen darstellen.
Der Link zur Studie:
nature.com/articles/s4158…
#COVID19 #SARSCoV2 #Coronavirus #COVID_19 #CovidIsNotOver #SARS2 #Covid_19 #CovidIsntOver
Der Link zur Studie:
nature.com/articles/s4158…
#COVID19 #SARSCoV2 #Coronavirus #COVID_19 #CovidIsNotOver #SARS2 #Covid_19 #CovidIsntOver
• • •
Missing some Tweet in this thread? You can try to
force a refresh