‼️Das Plasmaproteom von #LongCovid-Patienten weist auf eine Hypoxie-induzierte Faktor (HIF)-vermittelte vaskulo-proliferative Erkrankung mit tiefgreifenden Auswirkungen auf die Gehirn- und Herzfunktion hin
#SARSCoV2 kann den Gasaustausch beeinträchtigen,…🧵
#COVID19 #Corona
#SARSCoV2 kann den Gasaustausch beeinträchtigen,…🧵
#COVID19 #Corona

was zu akutem Atemnotsyndrom sowie systemischer Hypoxie führen kann, sprich eine Unterversorgung des Körpers mit Sauerstoff. Tritt eine Hypoxie ein, werden durch den Hypoxie-induzierten Faktor HIF-α Signalwege aktiviert, die für eine Anpassung an die Hypoxie relevant sind. 

Dies geschieht, indem HIF-α vom Zytoplasma in den Zellkern wandert, und zusammen mit anderen Transkriptionsfaktoren
die Expression spezieller Gene aktiviert. Dies ist u.a. relevant für
die EPO-Synthese (wichtig für die Synthese von sauerstofftransportierenden roten
die Expression spezieller Gene aktiviert. Dies ist u.a. relevant für
die EPO-Synthese (wichtig für die Synthese von sauerstofftransportierenden roten

Blutkörperchen) sowie Bildung neuer Gefäße über den vaskulo-endothelialem Wachstumsfaktor VEGF (besonders relevant bei Krebs für das Tumorwachstum).
Diese Studie zeigt auf, dass durch eine Hypoxie (lokal oder systemisch) und/oder durch stimulierende Faktoren (d. h. Zytokine,
Diese Studie zeigt auf, dass durch eine Hypoxie (lokal oder systemisch) und/oder durch stimulierende Faktoren (d. h. Zytokine,

Chemokine, Wachstumsfaktoren, Angiotensin usw.) ein vaskulo-proliferativen Prozess - unter Proliferation versteht man das schnelle Wachstum bzw. die Vermehrung oder Wucherung von
Zellen oder Mikroorganismen - mit tiefgreifenden Auswirkungen auf die Gehirn- und Herzfunktion
Zellen oder Mikroorganismen - mit tiefgreifenden Auswirkungen auf die Gehirn- und Herzfunktion
ausgelöst werden kann.
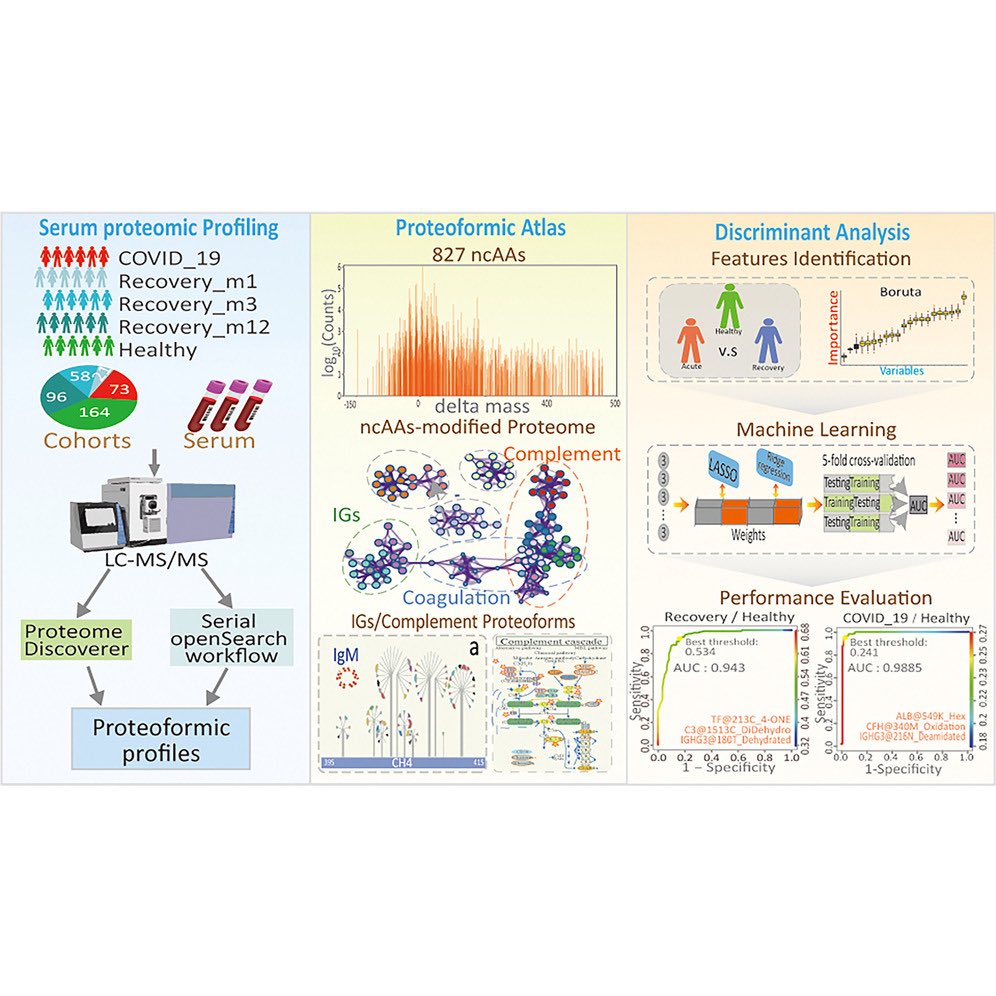
Um mögliche Mechanismen aufzuklären, wurde im Rahmen dieser Studie das Plasmaproteom von Long-COVID-Patienten als
Surrogat für Zell-/Gewebeaktivitäten untersucht; das Plasmaproteom wurde im Vergleich zu alters- und geschlechtsgleichen akut erkrankten
Um mögliche Mechanismen aufzuklären, wurde im Rahmen dieser Studie das Plasmaproteom von Long-COVID-Patienten als
Surrogat für Zell-/Gewebeaktivitäten untersucht; das Plasmaproteom wurde im Vergleich zu alters- und geschlechtsgleichen akut erkrankten

COVID-19-Patienten und gesunden Kontrollpersonen nach verschiedenen Zelltypen und Signalmechanismen aufgeschlüsselt. Außerdem wurde die Expression einzelner Biomarker in den Patientenkohorten analysiert, um den potenziellen Wert für diagnostische und prognostische Ziele zu
ermitteln. Diese Daten deuten darauf hin, dass Long-COVID das Potenzial hat, die Funktionalität mehrerer Organe durch die vaskulo-proliferativen Wirkungen stark zu beeinträchtigen. Die differentielle Proteinexpression und die Netzwerkanalyse zeigten eine Störung der Mechanismen 

zur Wiederherstellung des Gewebes, die in direktem Zusammenhang mit konzertierten HIF-, TNFα- und VEGFA-Signalwirkungen stehen könnten, die durch ANGPT1 verknüpft sind. Die Analysen von Long-COVID in dieser Studie deuten zudem darauf hin, dass Natürliche Killerzellen (NK-Zellen) 

ihren Phänotyp potenziell von einem aktivierten in einen Ruhezustand umschalten könnten (s. Abbildung).
Die Studie bietet nicht nur Einblicke in den Mechanismus der Pathologie von Long-COVID, sondern identifiziert auch potenzielle Biomarker und
Die Studie bietet nicht nur Einblicke in den Mechanismus der Pathologie von Long-COVID, sondern identifiziert auch potenzielle Biomarker und

therapeutische Strategien, die auf spezifische Immun- und Organmechanismen zugeschnitten sein könnten, um die anfänglichen Auswirkungen der Hypoxie zu bekämpfen.
Zusammenfassend lässt sich sagen, dass diese Studie einen pathophysiologischen Rahmen
Zusammenfassend lässt sich sagen, dass diese Studie einen pathophysiologischen Rahmen
für ein besseres Verständnis der funktionellen Heterogenität von Long-COVID bietet und Hinweise auf die neurologischen und kardio-metabolischen Grundlagen dieser Krankheit liefert. Die Ergebnisse deuten auf einen vaskulo-proliferativen Prozess bei Long-COVID hin, der 

wahrscheinlich entweder durch eine vorherige Hypoxie (lokal oder systemisch) und/oder durch stimulierende Faktoren (d. h. Zytokine, Chemokine, Wachstumsfaktoren, Angiotensin usw.) ausgelöst wird. Diese Studie stellt auch eine wertvolle Ressource für die Erforschung von Biomarkern 

bei #LongCovid und die Entwicklung potenzieller therapeutischer Ziele für die Vorbeugung und/oder Behandlung der Krankheit auf der Grundlage der enthüllten potenziellen pathophysiologischen Mechanismen dar.
…nslational-medicine.biomedcentral.com/articles/10.11…
#MECFS #COVID19 #Coronavirus #SARSCoV2 #MaskUp
…nslational-medicine.biomedcentral.com/articles/10.11…
#MECFS #COVID19 #Coronavirus #SARSCoV2 #MaskUp
• • •
Missing some Tweet in this thread? You can try to
force a refresh