Endotheliale Dysfunktion bei #COVID19: ein Überblick über Erkenntnisse, Biomarker, Mechanismen und potenzielle Therapien
Das vaskuläre Endothel, die innerste Schicht der Blutgefäße, bildet eine dynamische Schnittstelle zwischen dem zirkulierenden Blut und…
#LongCovid #Corona
Das vaskuläre Endothel, die innerste Schicht der Blutgefäße, bildet eine dynamische Schnittstelle zwischen dem zirkulierenden Blut und…
#LongCovid #Corona
verschiedenen Geweben/Organen und sorgt so für die Aufrechterhaltung der Gewebehomöostase. Zu den physiologischen Funktionen des Endothels gehören die Feinsteuerung des Gefäßtonus, die Blutstillung im Gewebe, die Integrität der Barriere, Entzündungen, oxidativer Stress, die 

Gefäßpermeabilität sowie die strukturelle und funktionelle Integrität. Eine Reihe von Virenarten wie Dengue und Ebola können Endothelzellen infizieren und eine endotheliale Dysfunktion verursachen. Es gibt nun immer mehr Belege dafür, dass die Endothelfehlfunktion ein 

einheitlicher Schlüsselmechanismus in der Pathogenese von COVID-19 ist. Daher wird das Endothel als die Achillesferse von COVID-19-Patienten angesehen. Histopathologische Beobachtungen zeigen, dass es sich bei COVID-19 um eine (mikro)vaskuläre und endotheliale Erkrankung handelt, 

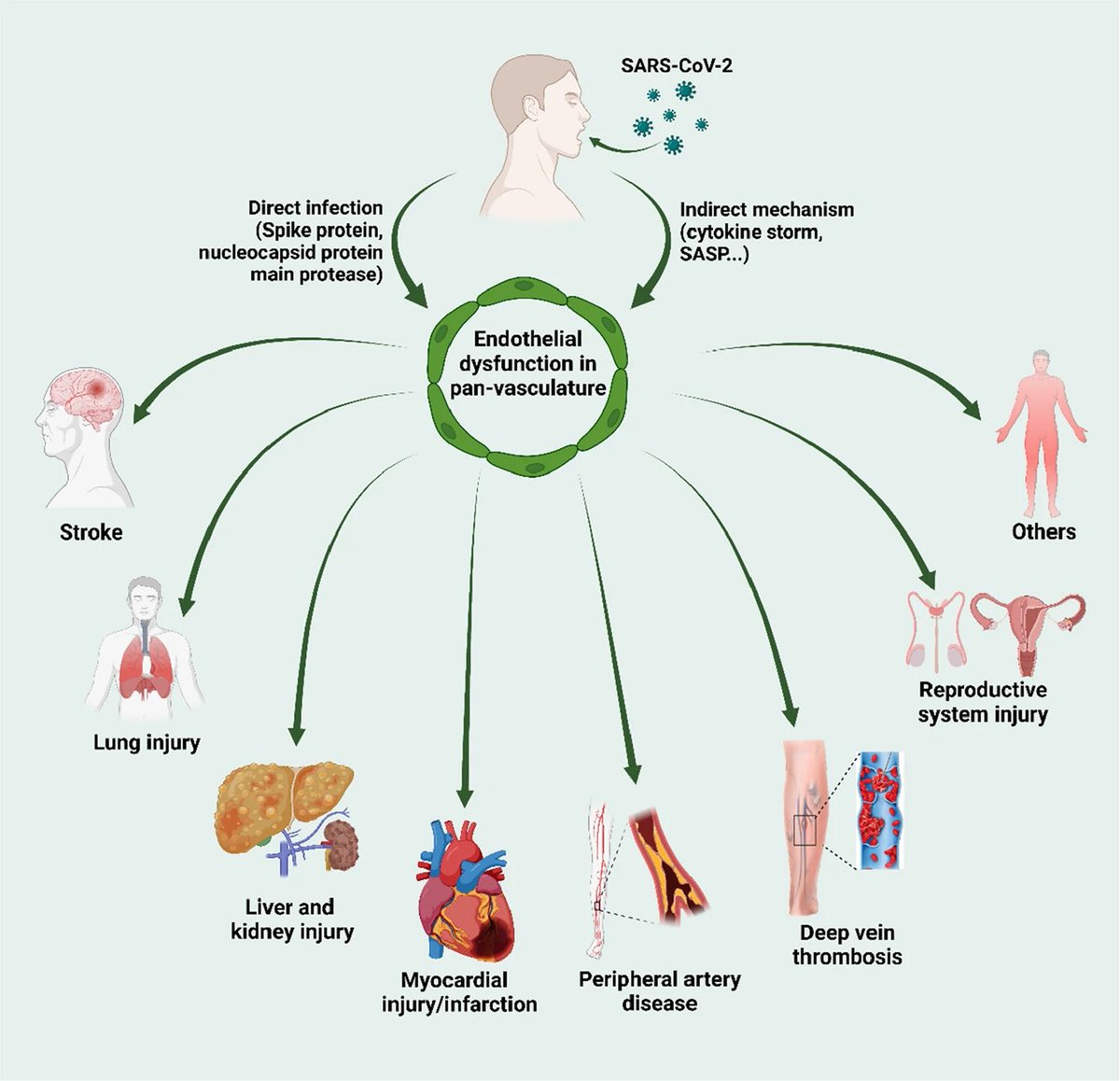
bei der die endotheliale Dysfunktion eine grundlegende Rolle spielt. Direkte oder indirekte Mechanismen nach einer SARS-CoV-2-Infektion und die daraus resultierende Endotheliitis/Endotheliopathie führen zu einer Vielzahl von Endotheldysfunktionen, einschließlich verändertem
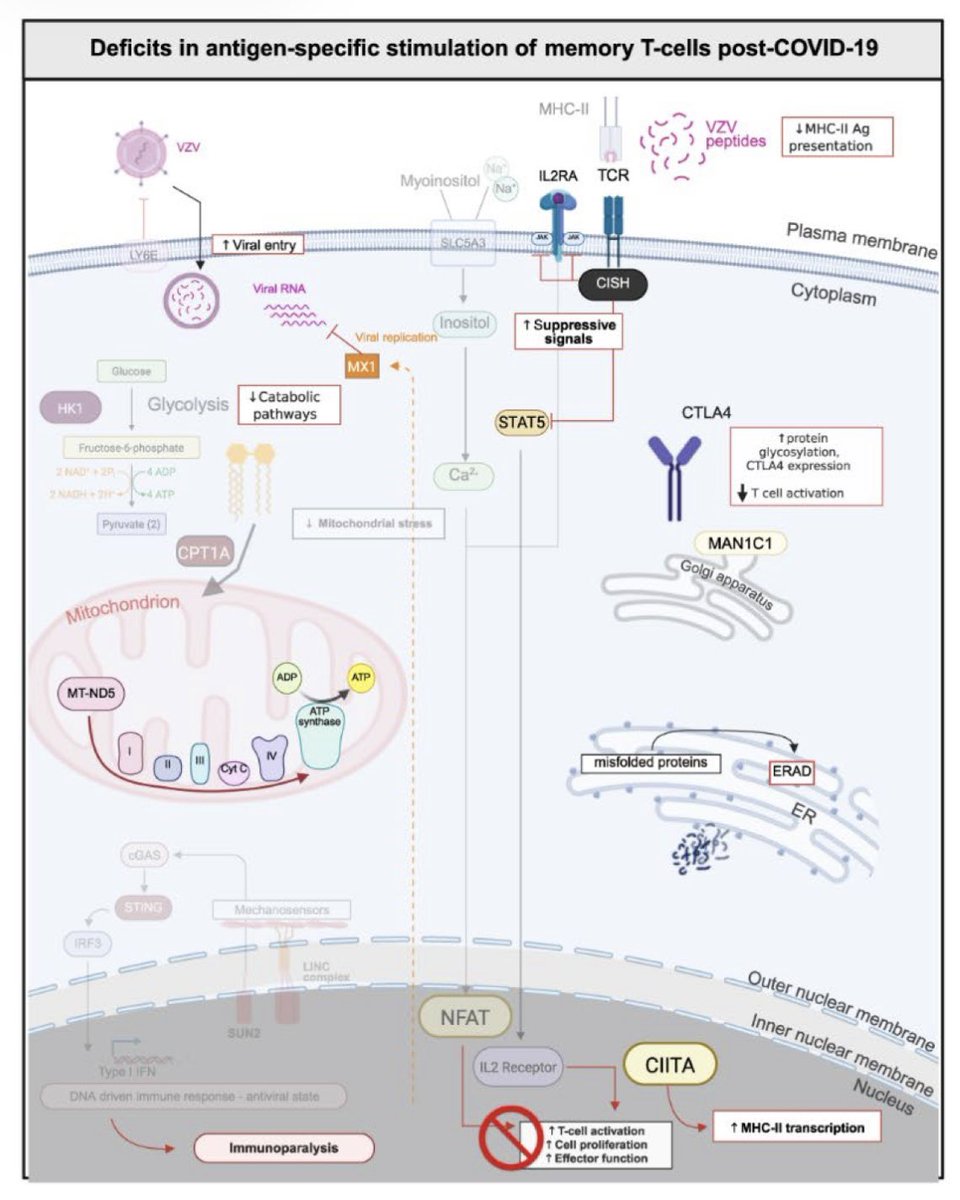
Gefäßtonus, oxidativem Stress, Entzündung/Leukozytenadhäsion, endothelialer mesenchymaler Transition (EndoMT), Mitochondriendysfunktion, virusinduzierter Seneszenz, Zytokinsturm und Koagulopathie. Zusammengefasst führt das Zusammenwirken der oben genannten Faktoren zu einem
dysfunktionalen Zustand des Gefäßendothels (endotheliale Dysfunktion). Eine SARS-CoV-2-Infektion oder eine indirekte Auswirkung der SARS-CoV-2-Infektion führt also zu einer endothelialen Dysfunktion in den Blutgefäßen, die zur Entwicklung von Gewebeschäden an mehreren Organen 

(Multiorganschäden) führt. Ziel dieser Studie ist es, einen aktuellen Überblick über die Biomarker zu geben, die mit der Endothelzellaktivierung bei COVID-19 assoziiert sind, und mechanistische Einblicke in die molekularen Grundlagen der endothelialen Aktivierung/Dysfunktion in 
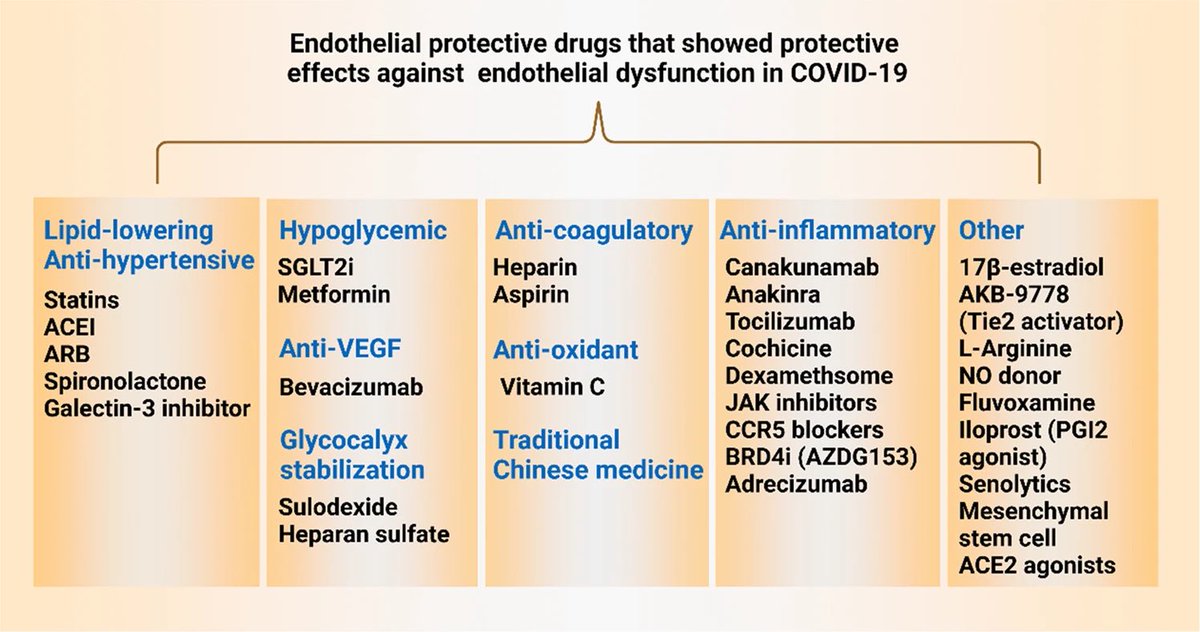
der Makro- und Mikrovaskulatur von COVID-19-Patienten zu geben.
Hier der Link zur Studie:
nature.com/articles/s4140…
#COVID19 #LongCovid #Covid_19 #Corona #SARSCoV2 #Omicron #ImpfenSchuetzt #MECFS #VorbilderTragenMaske #DieMaskeBleibtAuf
Hier der Link zur Studie:
nature.com/articles/s4140…
#COVID19 #LongCovid #Covid_19 #Corona #SARSCoV2 #Omicron #ImpfenSchuetzt #MECFS #VorbilderTragenMaske #DieMaskeBleibtAuf
• • •
Missing some Tweet in this thread? You can try to
force a refresh