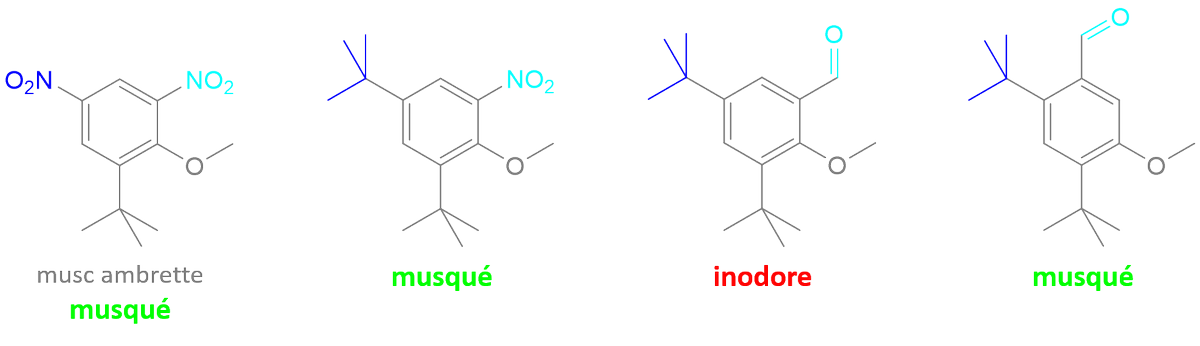
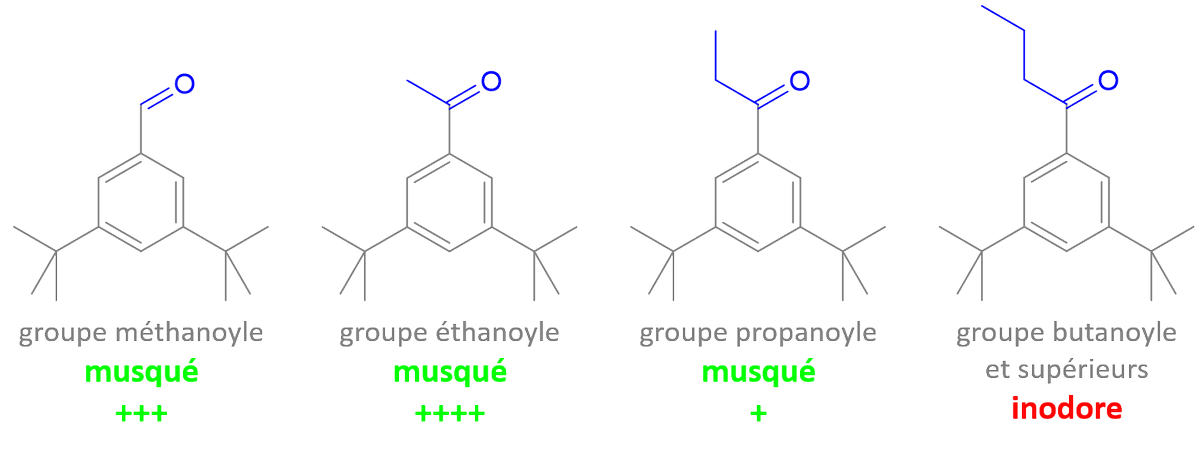
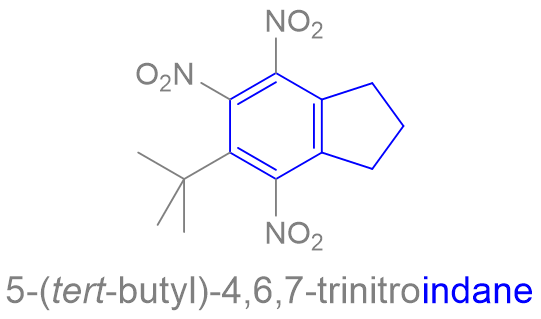
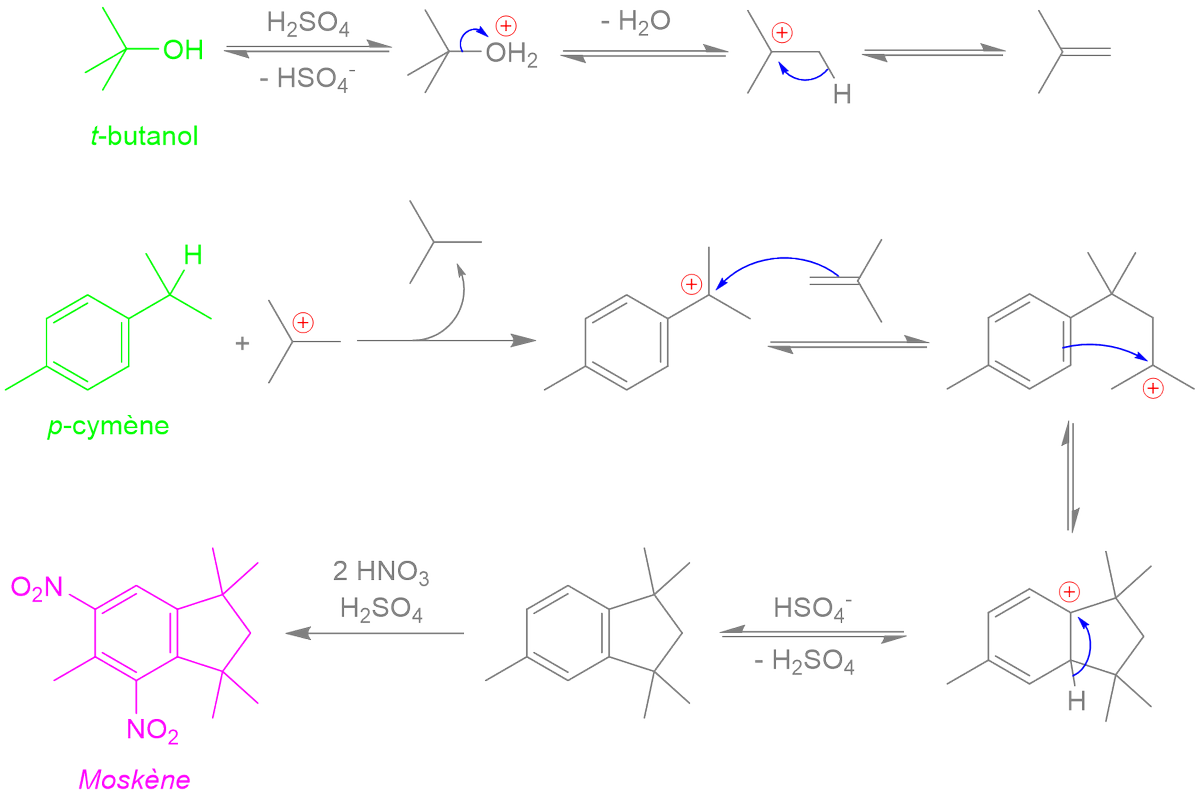
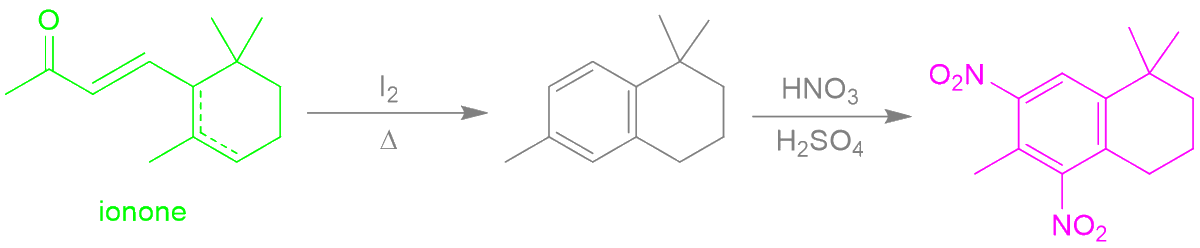
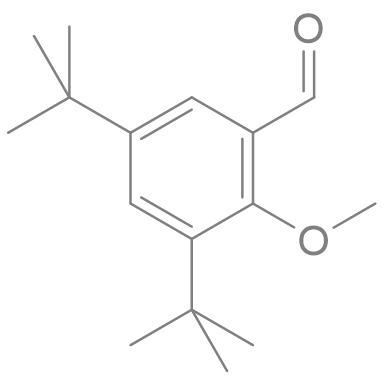
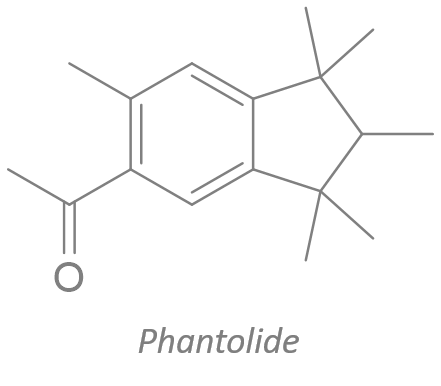
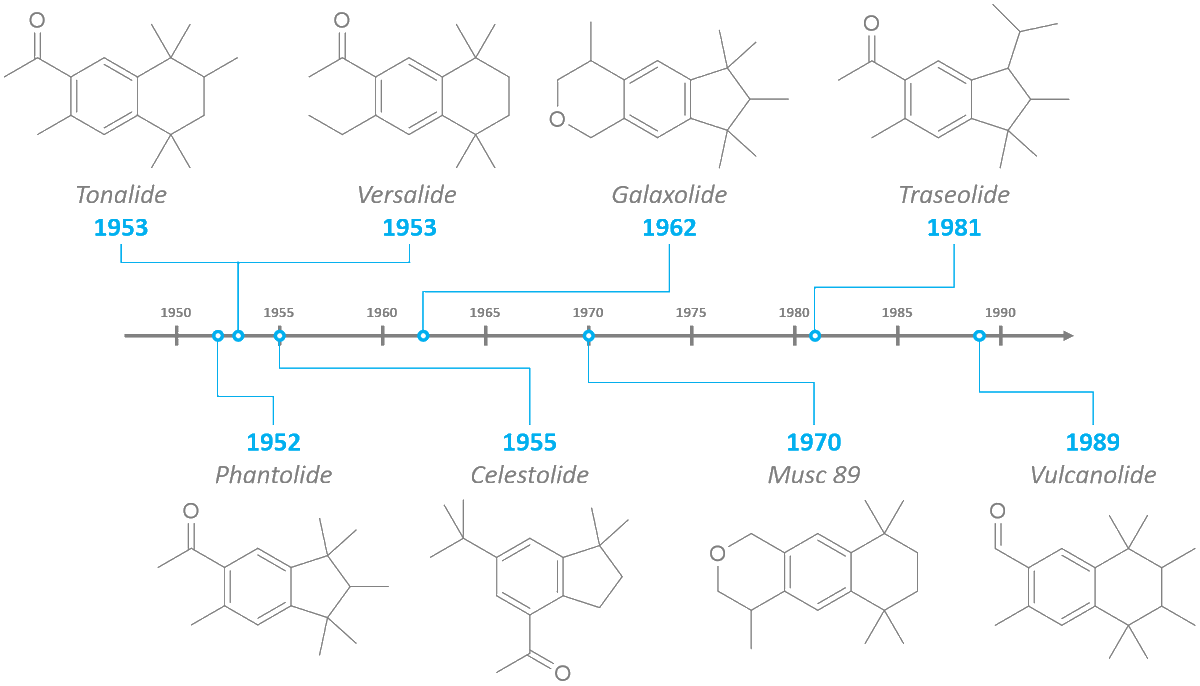
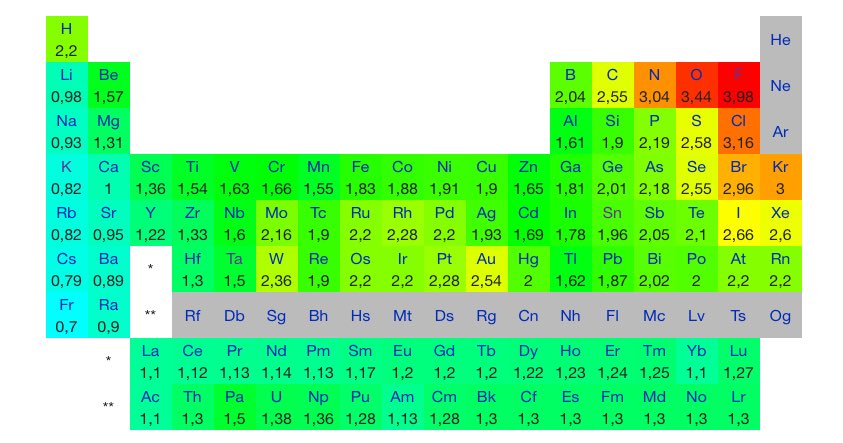
1 fav = une information en chimie que tu pourras ressortir en soirée.
A la place, il a fourni l'info à Watson & Crick
anagrammy.com/elements.html

Cassez-les, coiffez puis reformez-les = une permanente
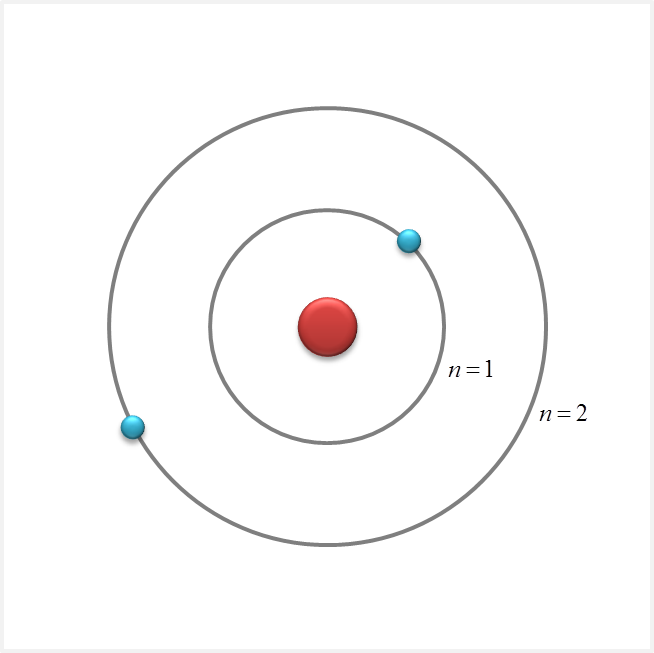
2/n,n=2

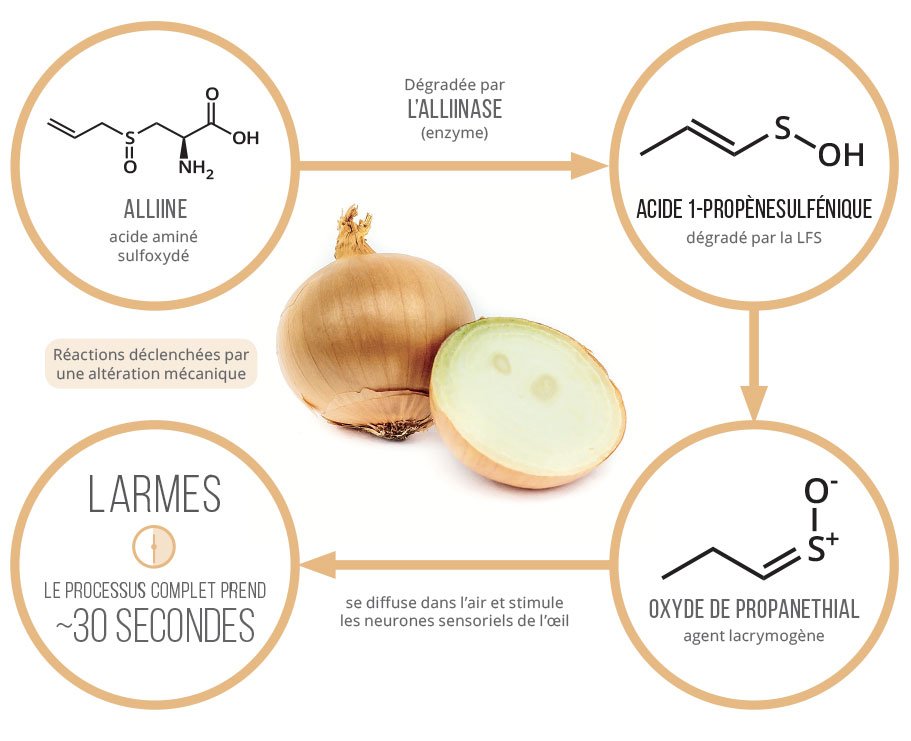
- isoler vos yeux (masque de plongée...)
- solubiliser les lacrymogènes (sous l'eau...)
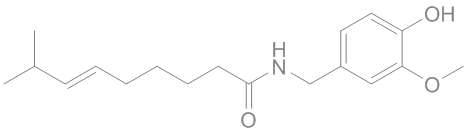
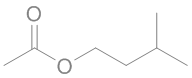
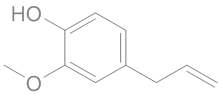

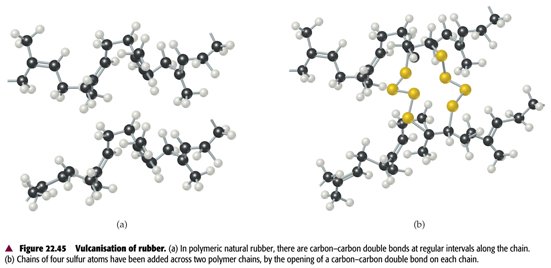
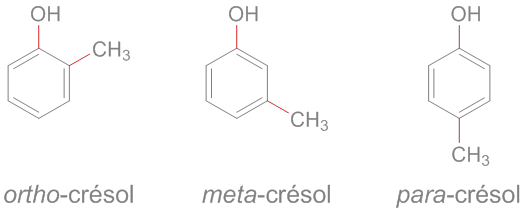
ὀρθός = droit, juste
μετά = après, au-delà
παρά = à côté, contre
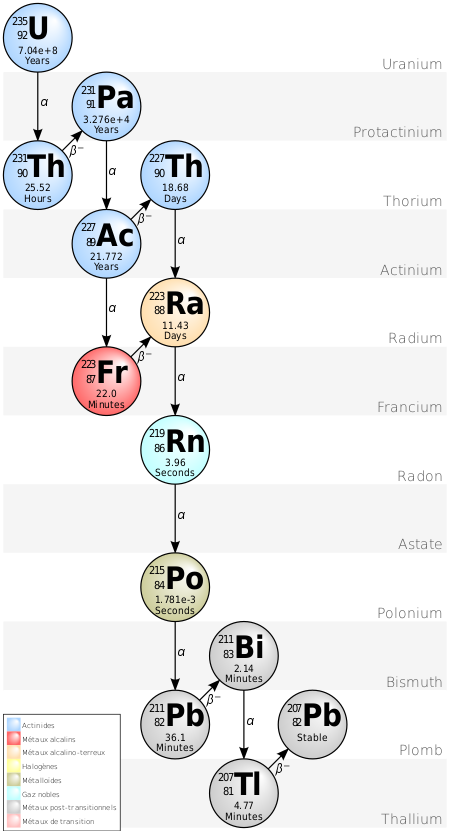
Du fait de la différence de masse, les cinétiques de réactions changent

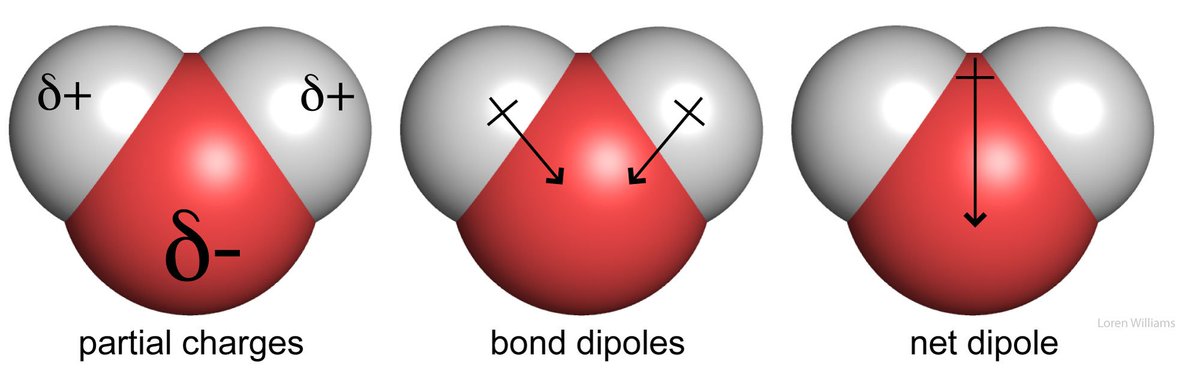
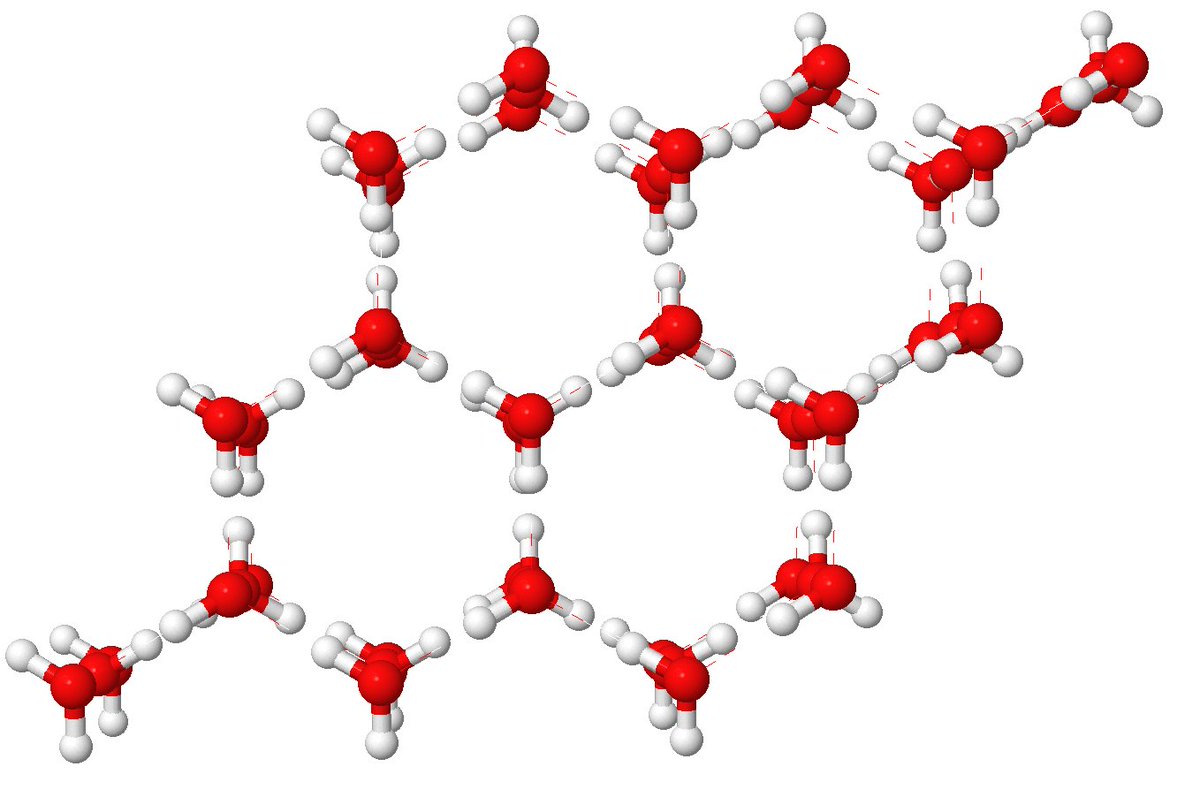




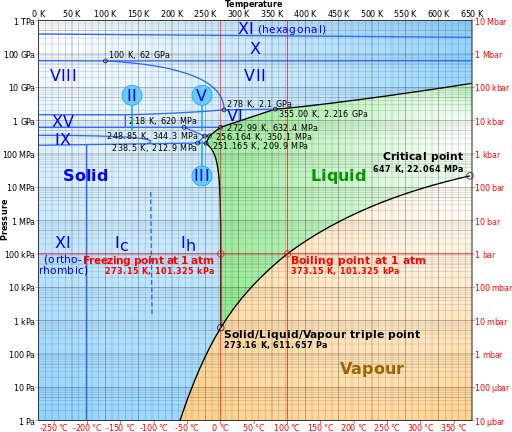



2/n n=2


CuCl = cuivreux
CuCl₂ = cuivrique
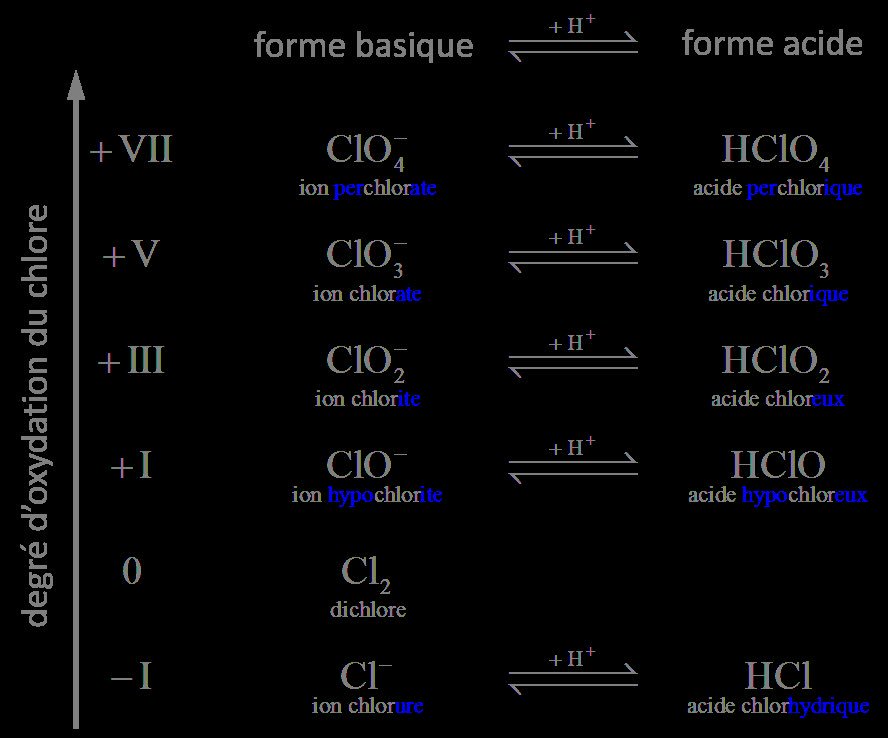
Avec les électrons, la définition a été généralisée
En effet, il existe aussi l'état +IV

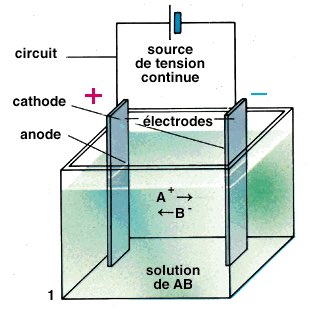
Petite astuce : ANION a ➖ de lettres, CATION en a le ➕ 😉
- une Oxydation à l'Anode
- une Réduction à la Cathode
(Astuce : au début des mots, voyelle+voyelle)
combustion de l'hydrogène : 2 H₂ + O₂ → 2 H₂O
oxydation du mercure : 2 Hg + O₂ → 2 HgO
[235] H₂ + Cl₂ → 2 HCl
[244] Hg + Cl₂ → HgCl₂
oxydant + électron(s) = réducteur
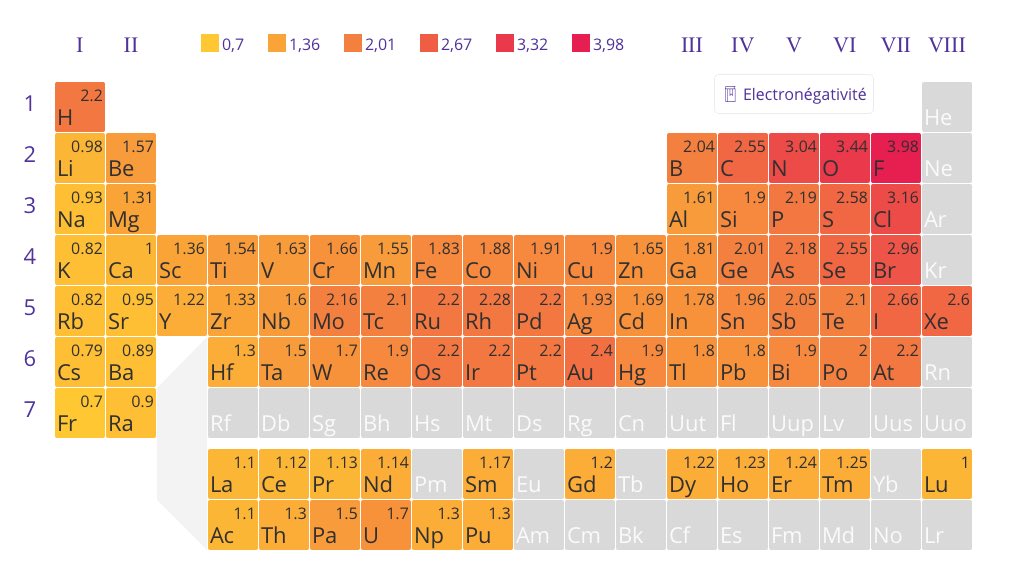

En effet, dans Cl₂ par ex, aucun Cl n'a l'avantage.
Par ex, pour l'ion chlorate ClO₃⁻ :
n.o. d'un O=-II
n.o. du Cl+3×(-2)=-1 ⇒ n.o. de Cl=-V
➕ anode : 2 Cl⁻ → Cl₂ + 2e⁻
➖ cathode : 2 H₂O + 2e⁻ → H₂ + 2 HO⁻
Cl₂ + 2 NaOH → NaClO + NaCl + H₂O
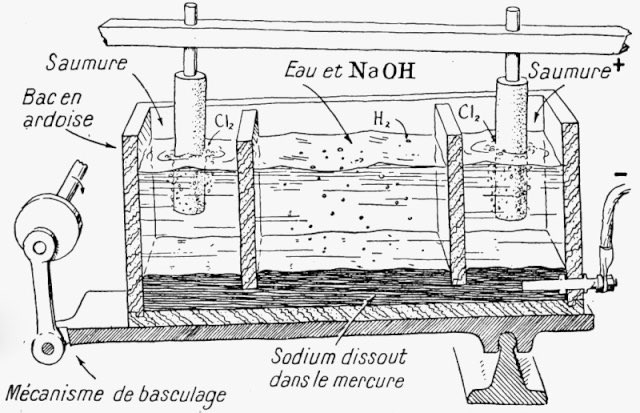
2 Na + 2 H₂O → 2 NaOH + H₂
Donc ⚠️ ne mélanger pas les produits ménagers !
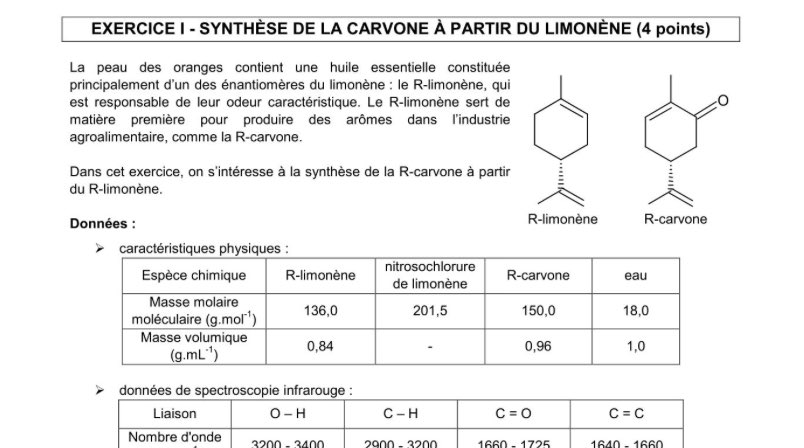
Le suspect : un fabriquant de propulseurs pour missile
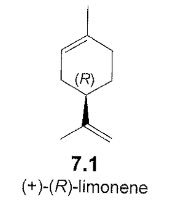
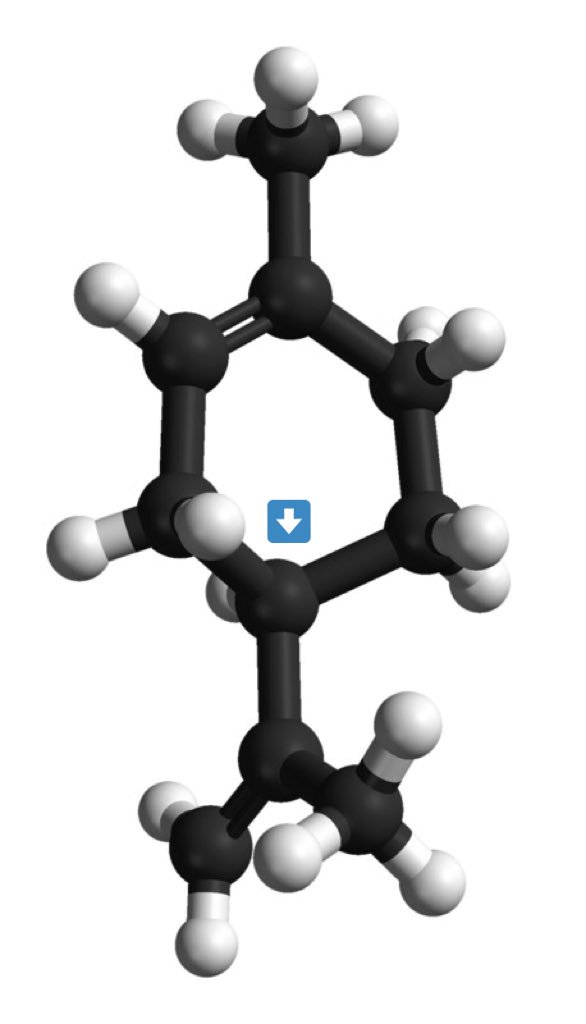
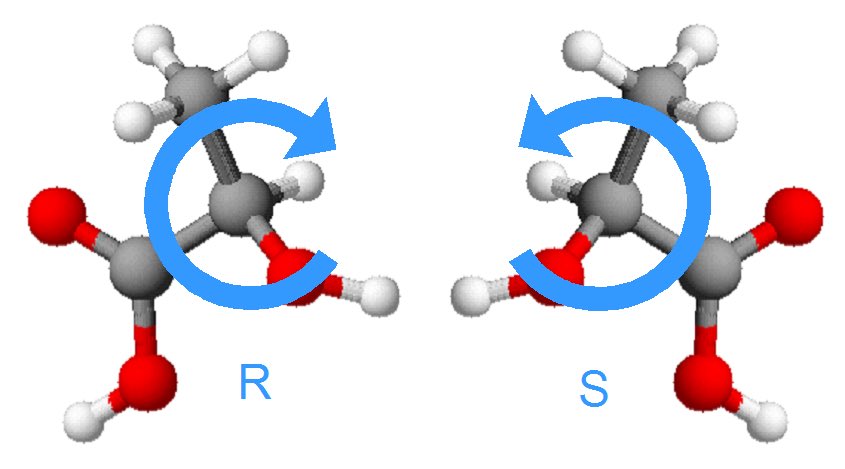
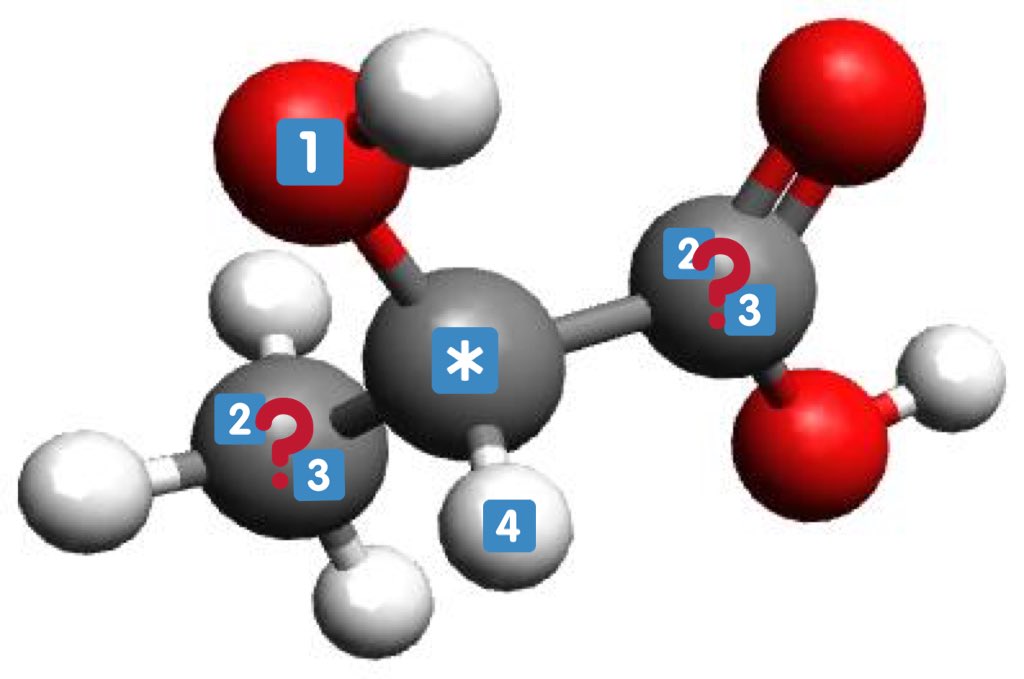
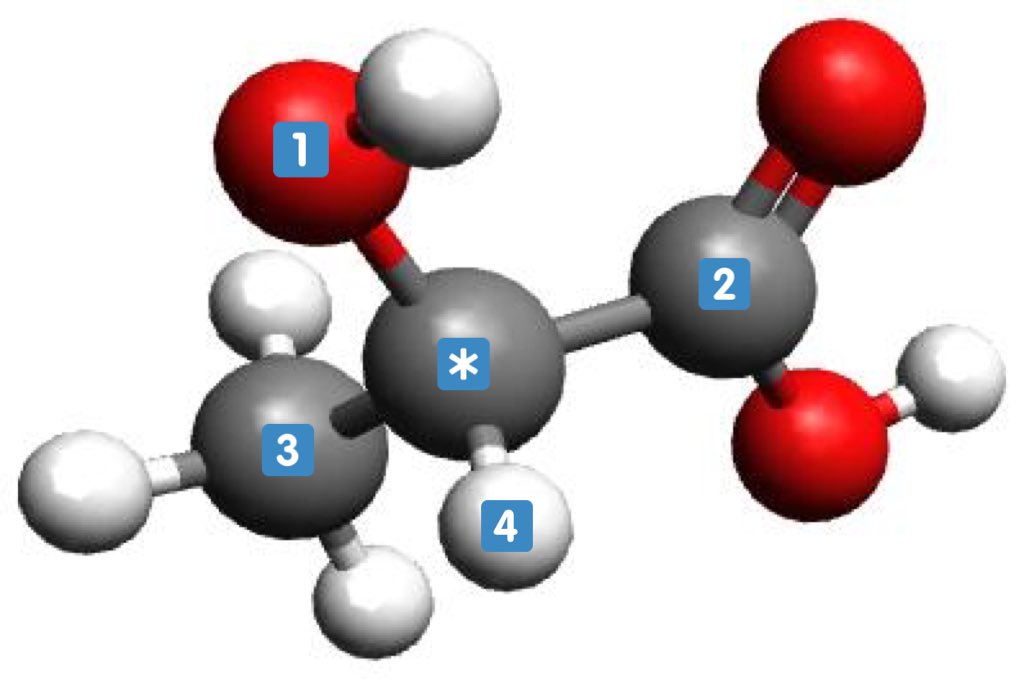
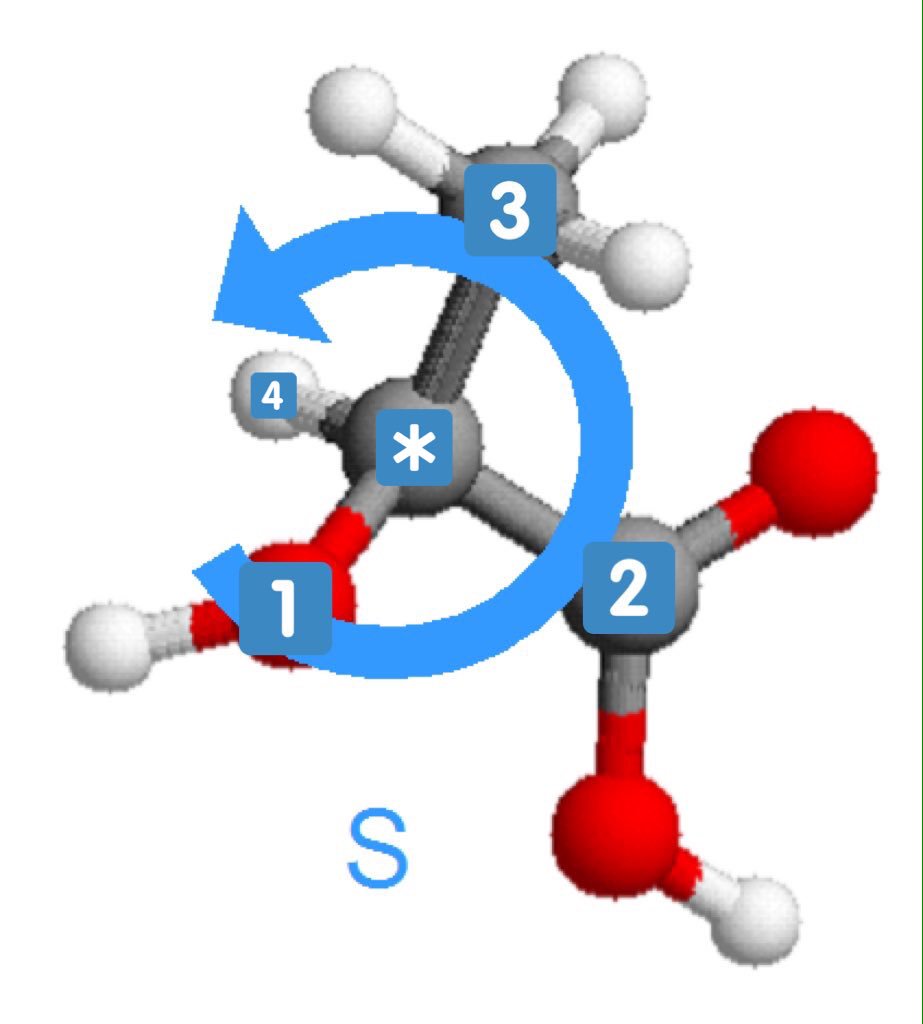
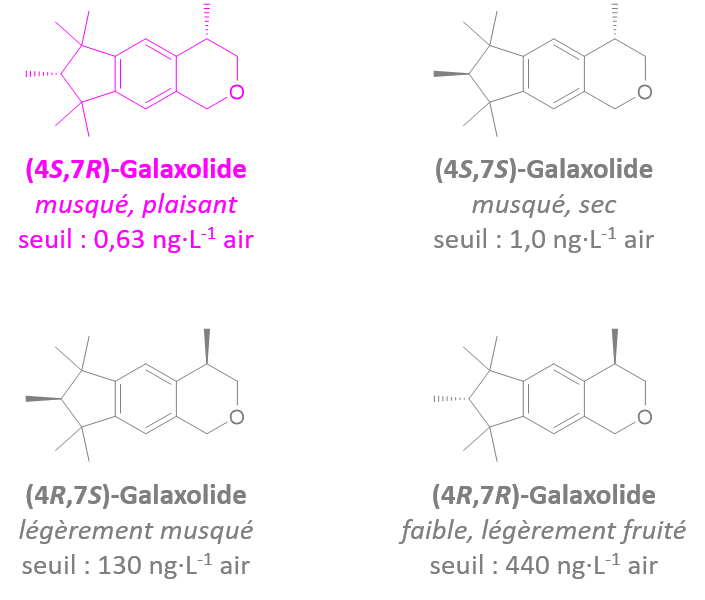
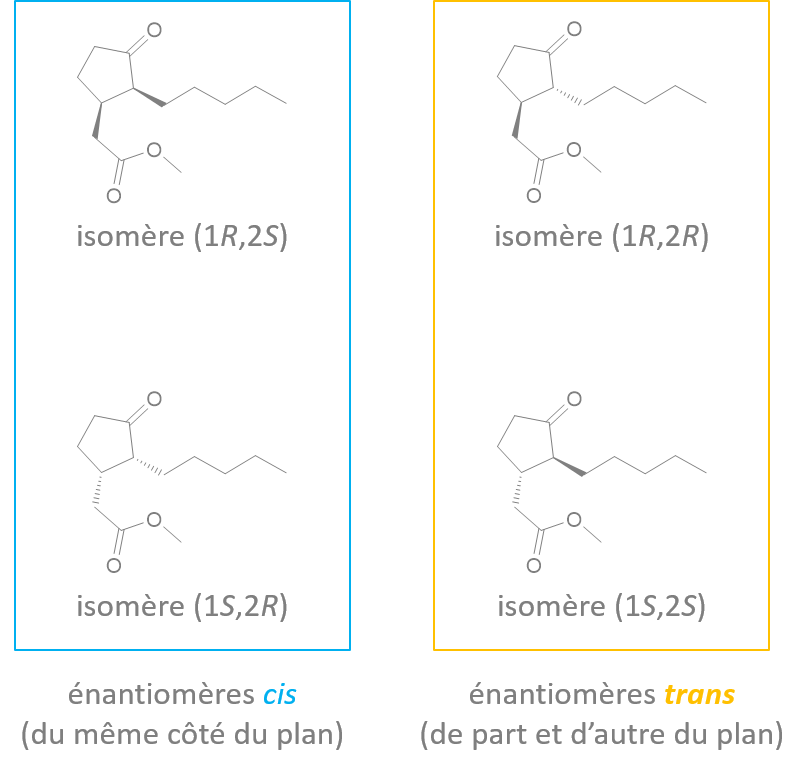
Ce sont l'image l'un de l'autre dans un miroir et non superposables (on peut différencier main droite et main gauche)

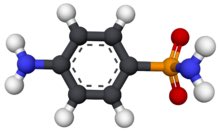


Au + 3 NO₃⁻ + 6 H⁺ + 4 Cl⁻ → AuCl₄⁻ + 3 NO₂ + 3 H₂O





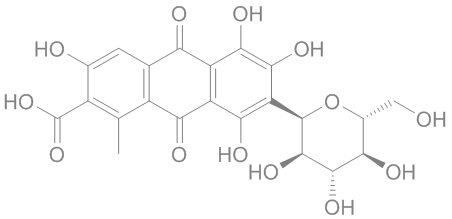
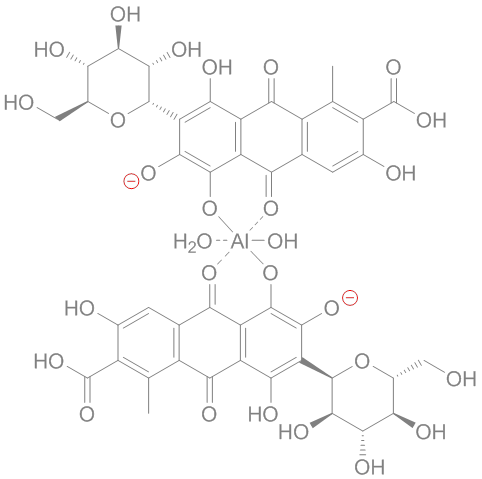


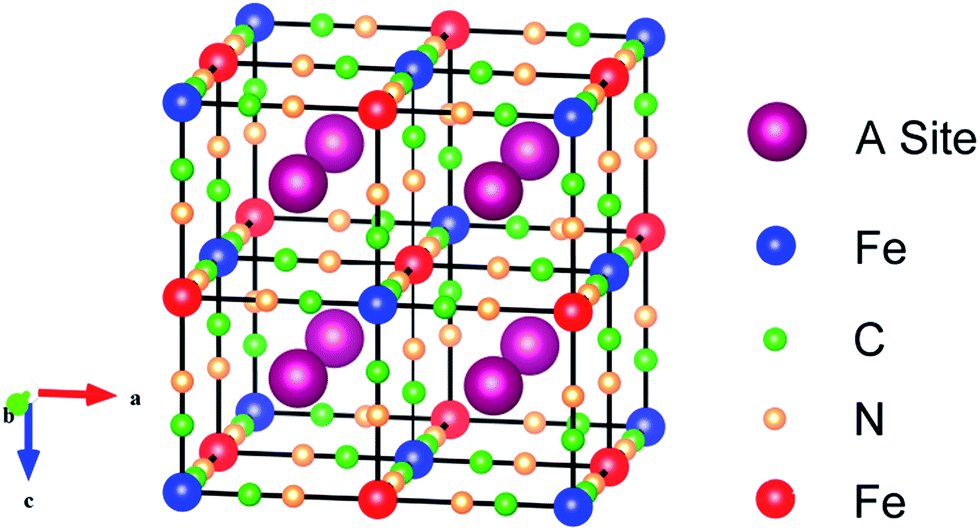


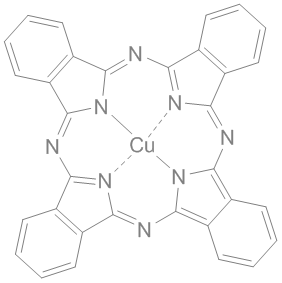

2 Br⁻ + Cl₂ → Br₂ + 2 Cl⁻



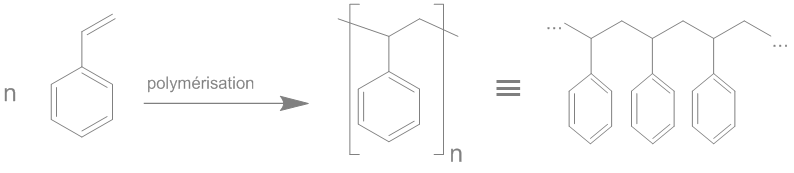


🇫🇷 "tube à essai" → "éprouvette"
🇫🇷 "éprouvette graduée" → "cylindre gradué"









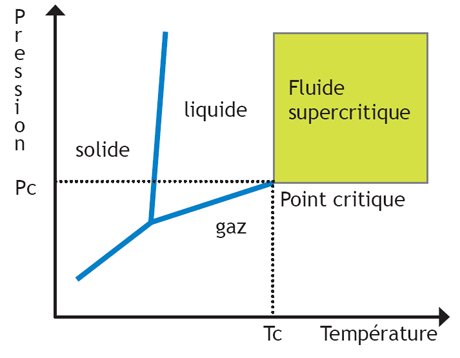
1/5 : Le gaz est composé de corps monoatomiques rigoureusement identiques.

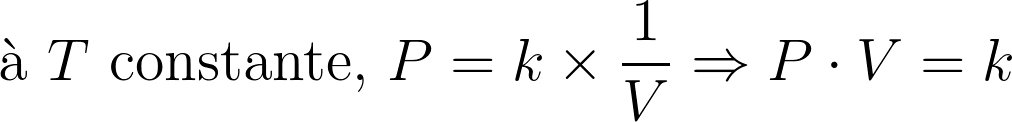
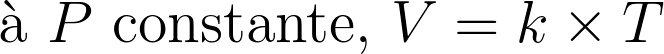
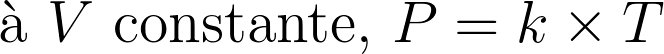
A pression et température donnée, tous les gaz parfaits ont le même volume molaire.
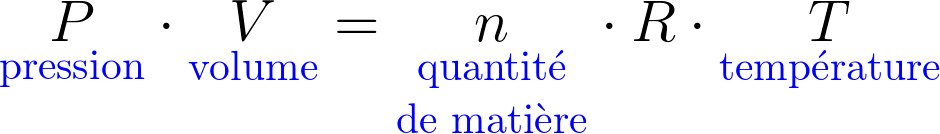
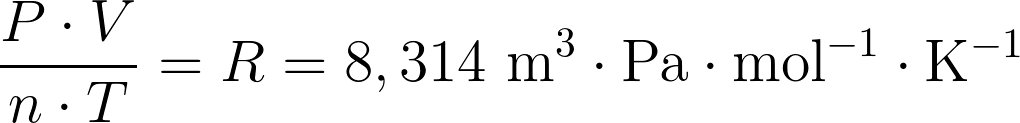

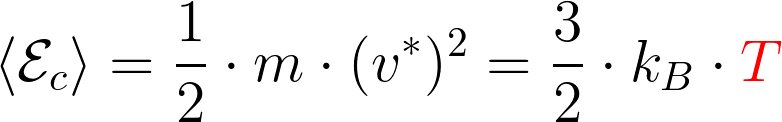
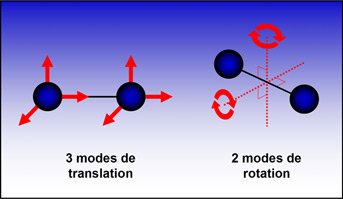
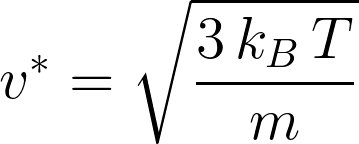

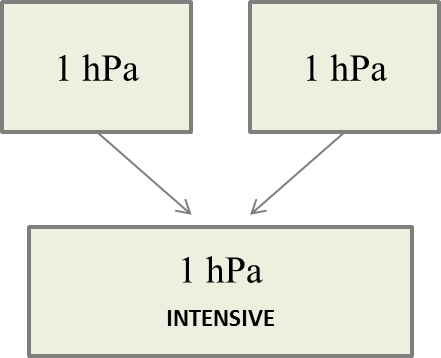
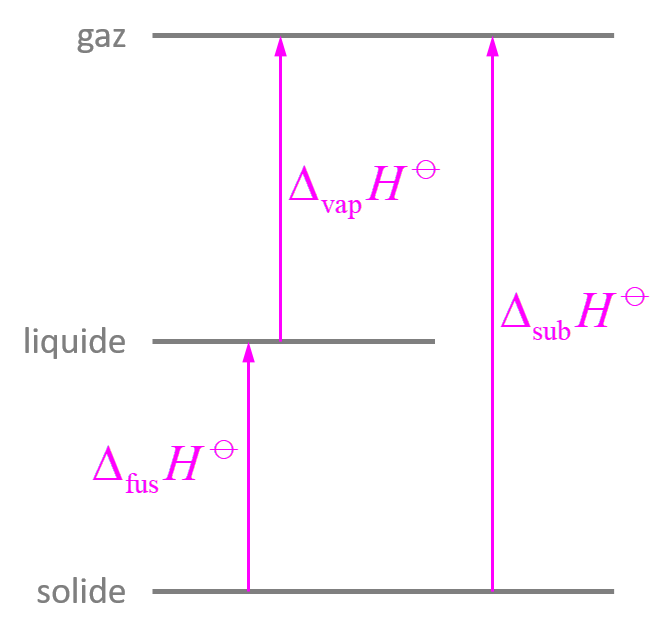
Pour la transformation d'un système fermé macroscopiquement au repos, 2 contributions :




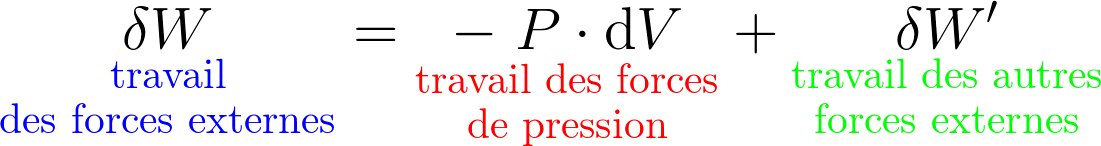
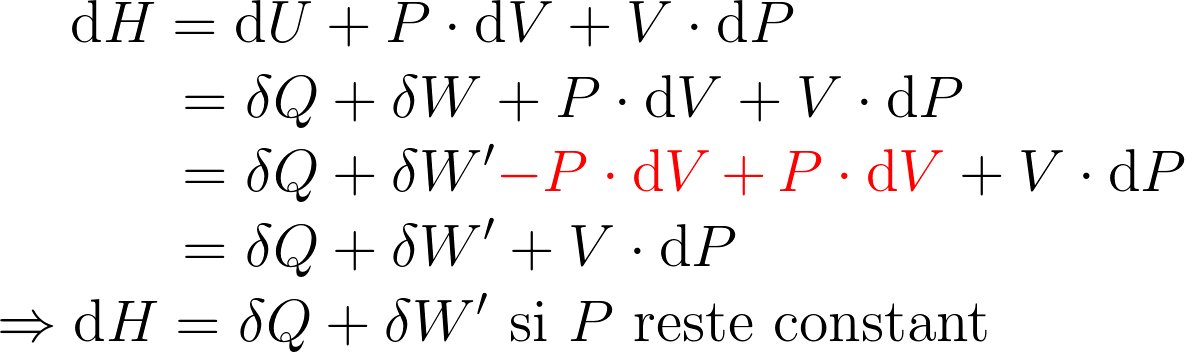
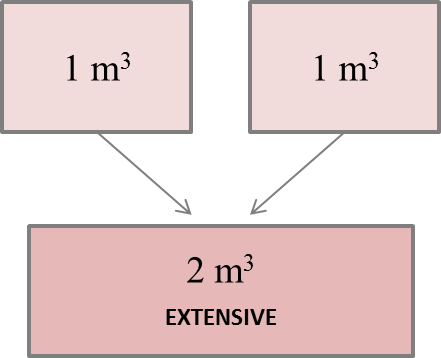
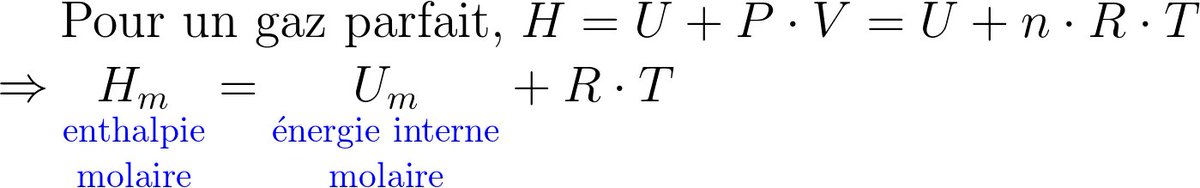
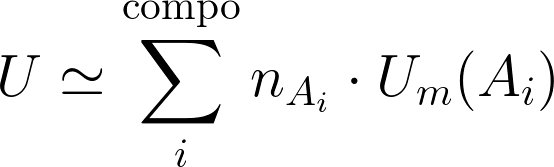
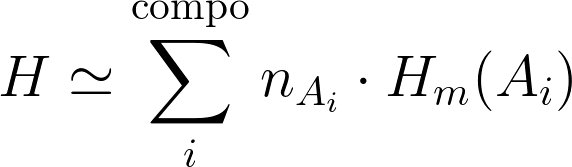
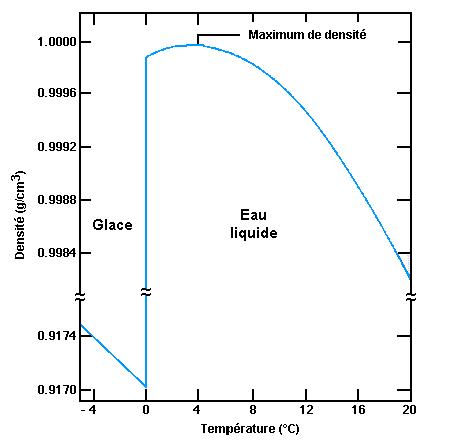
100 mL d'eau + 100 mL d'éthanol = 192 mL de mélange ⚠️
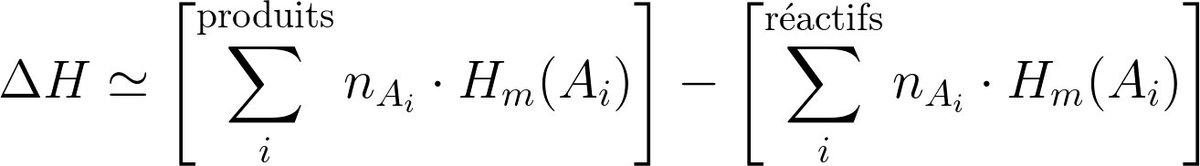

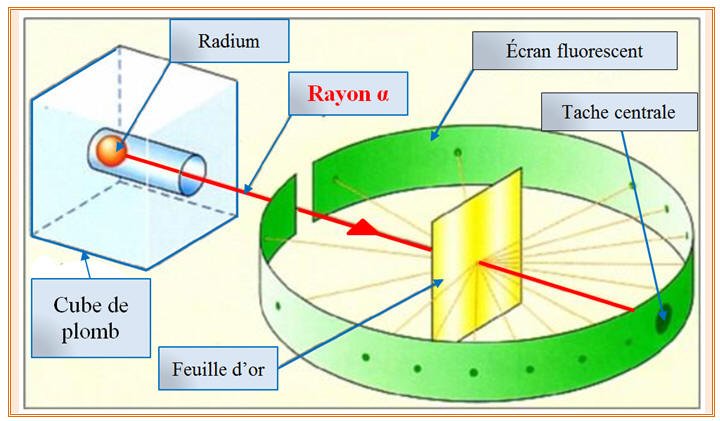
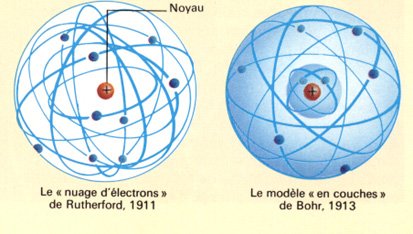

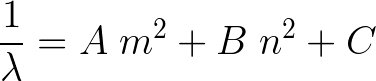
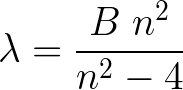
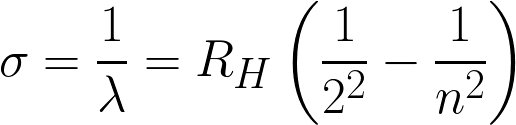
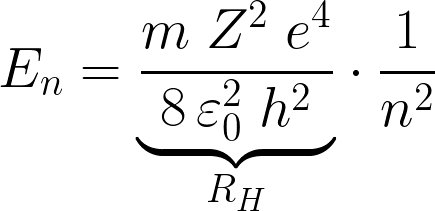



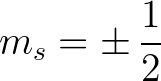
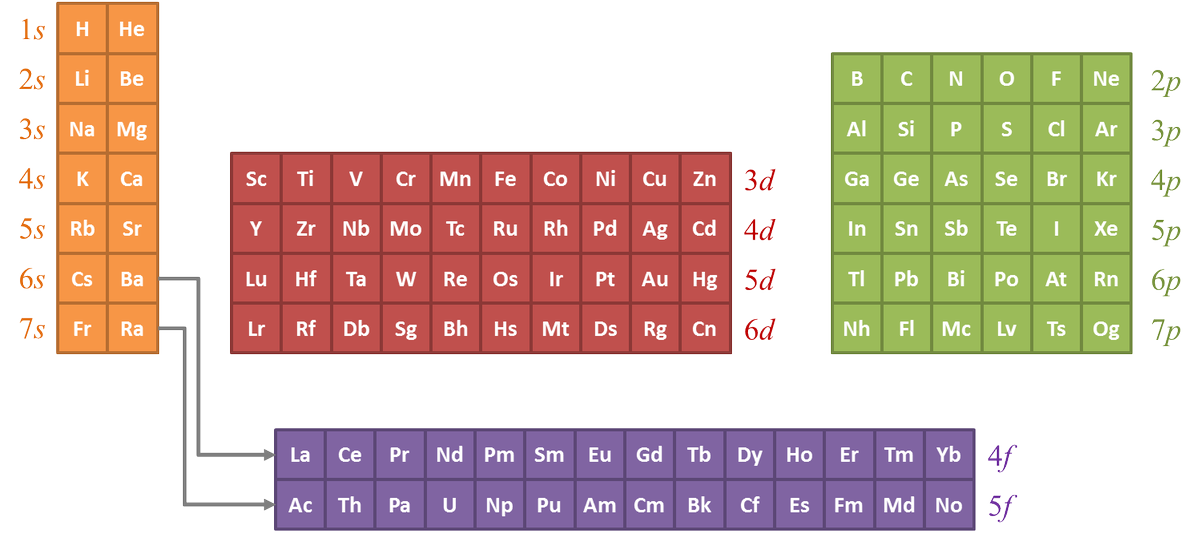
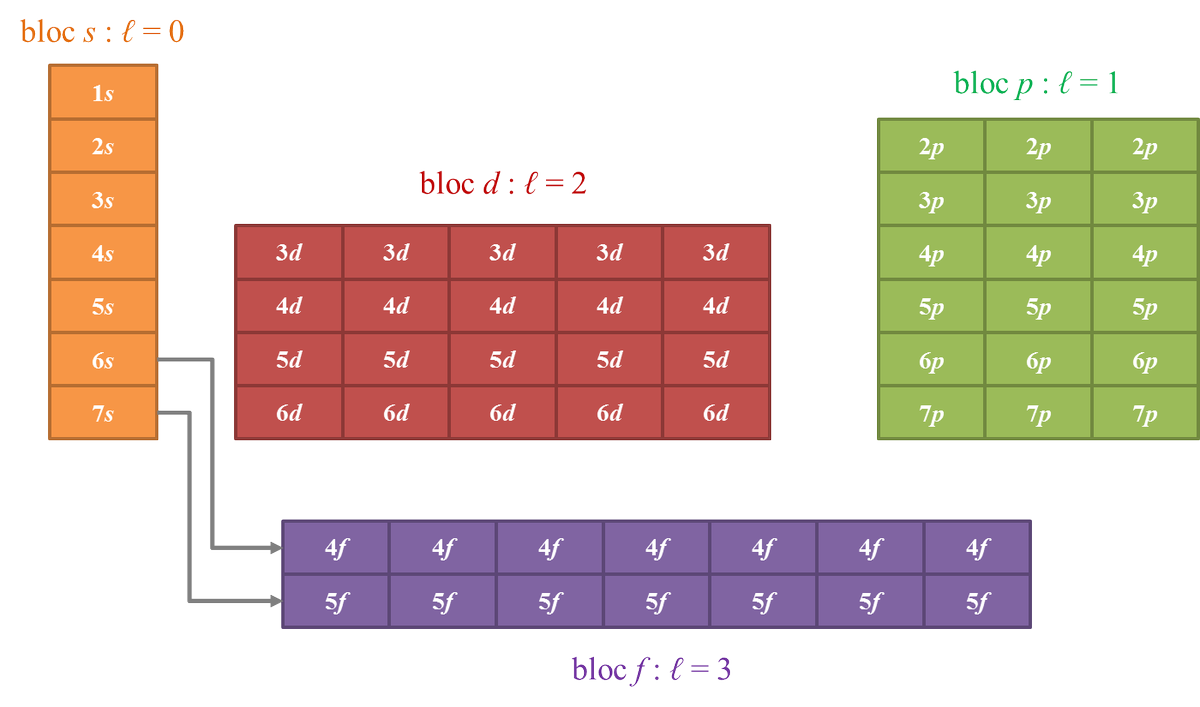
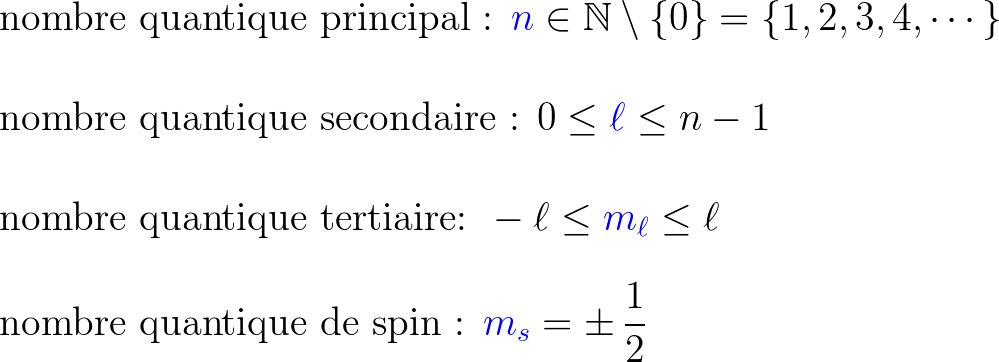
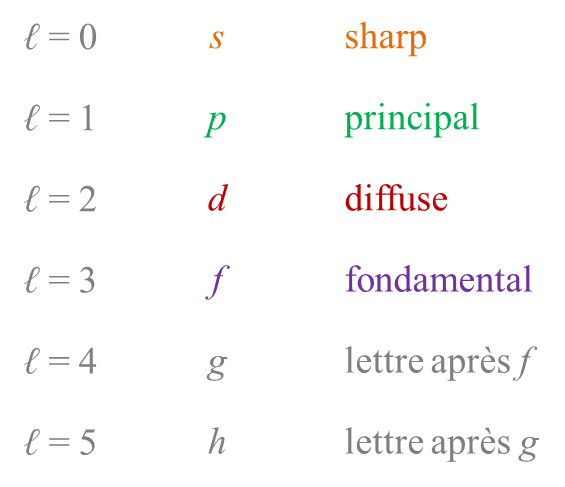


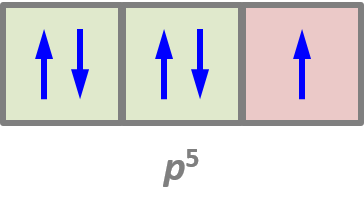


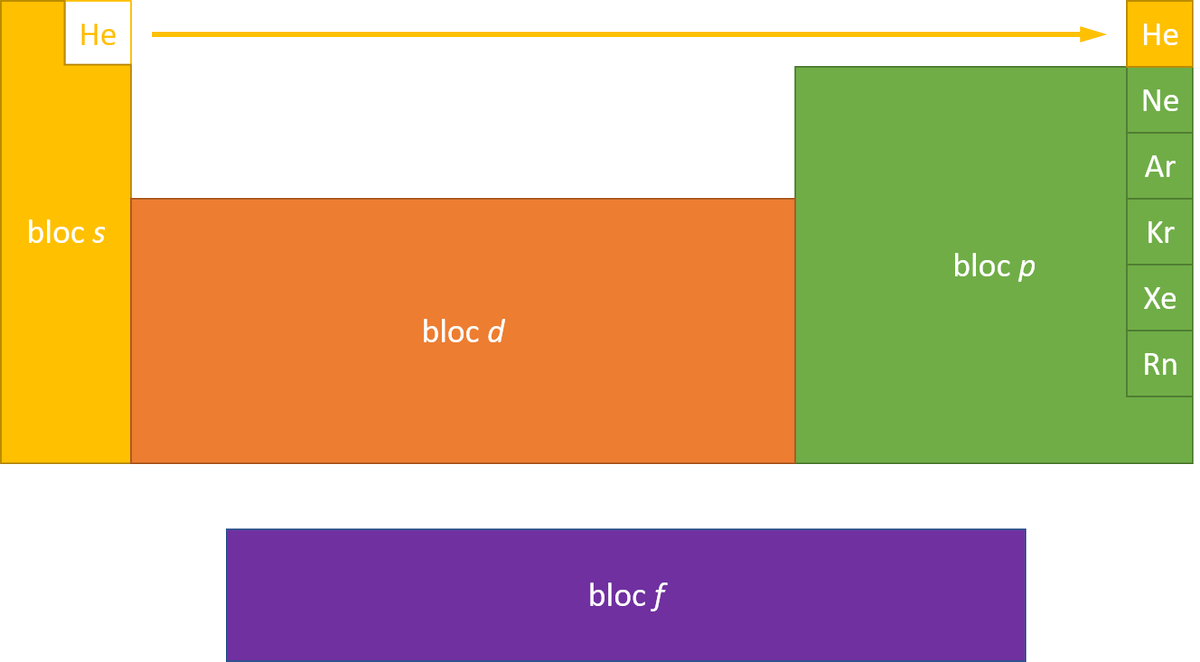
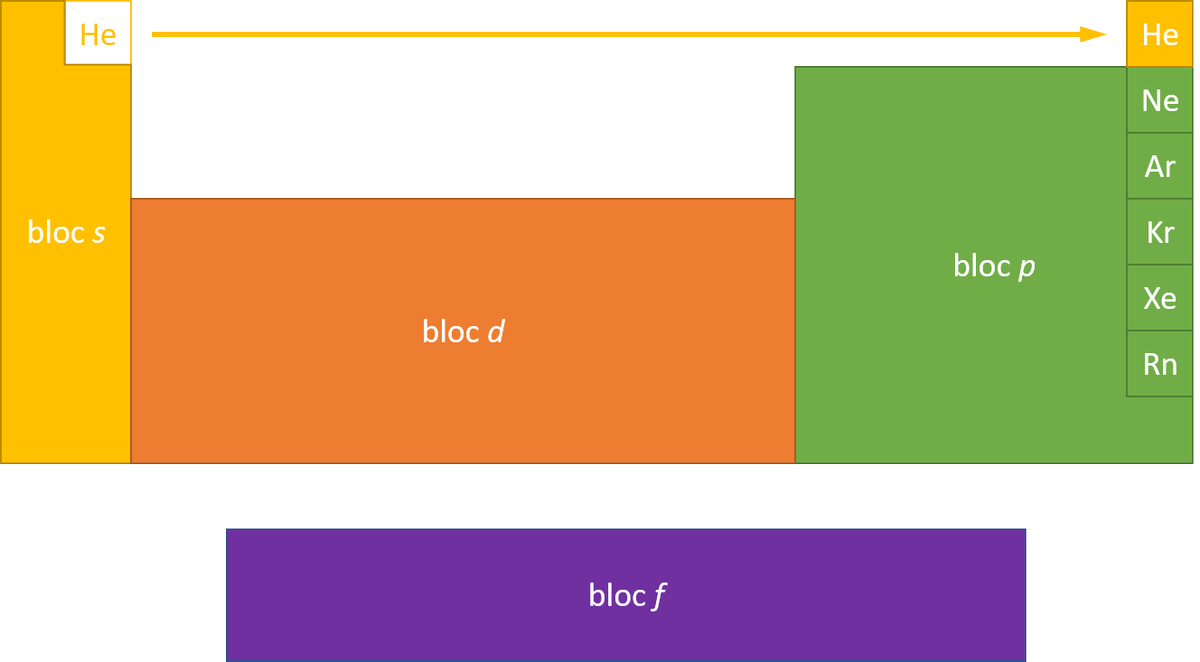

perte d'un électron : Na → Na⁺ + e
réduction de l'eau : 2 H₂O + 2 e⁻ → 2 HO⁻ + H₂

Et un vol d'un électron : F₂ + 2 e⁻ → 2 F⁻
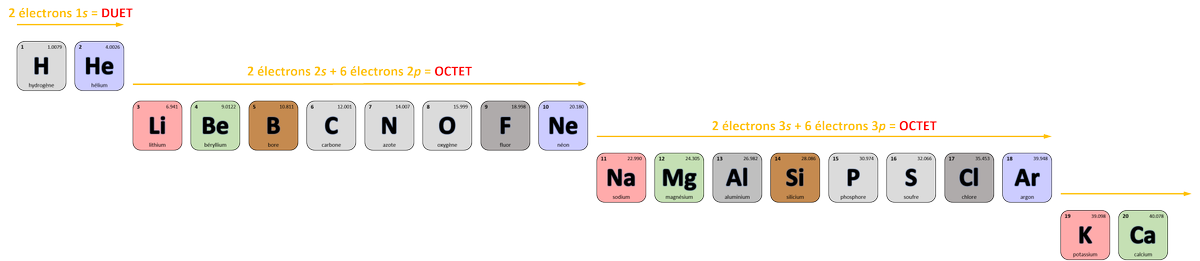
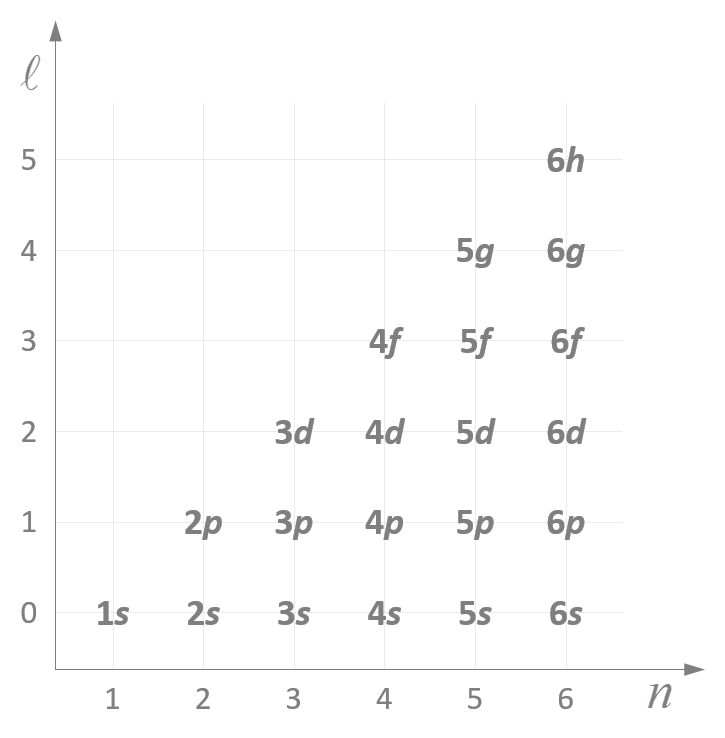
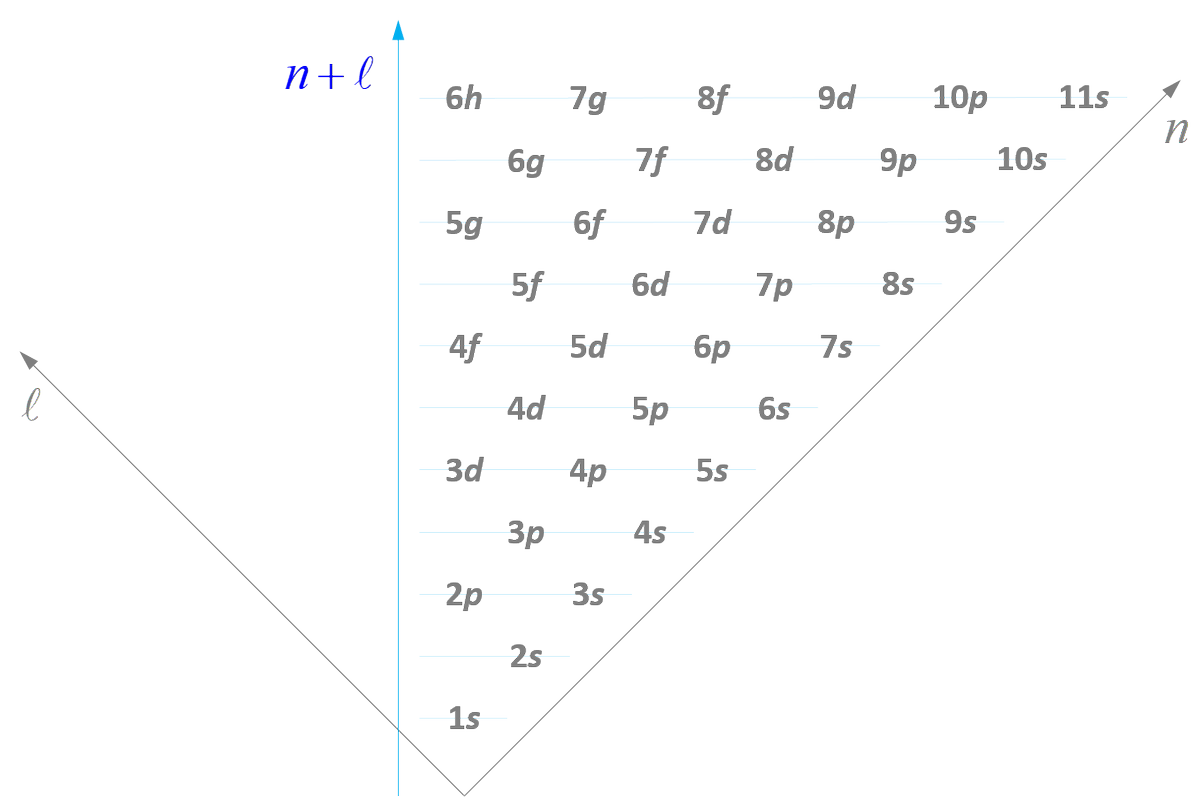
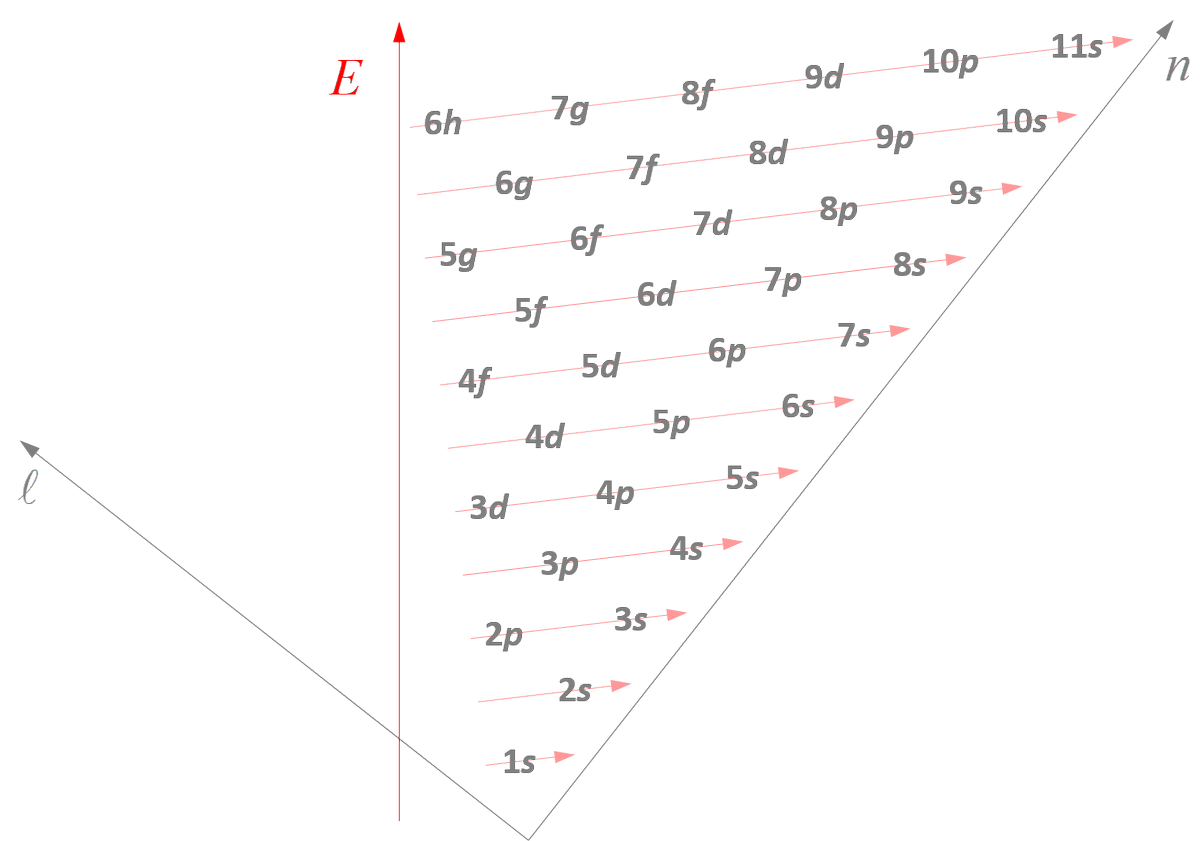
Comme prévu :
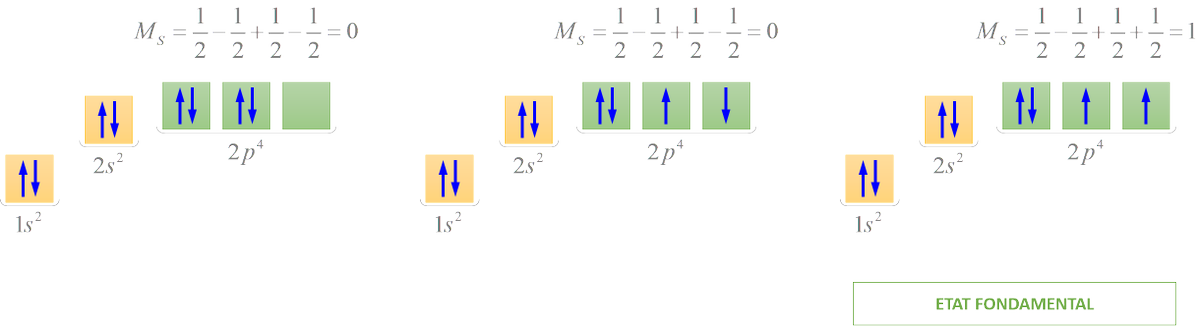

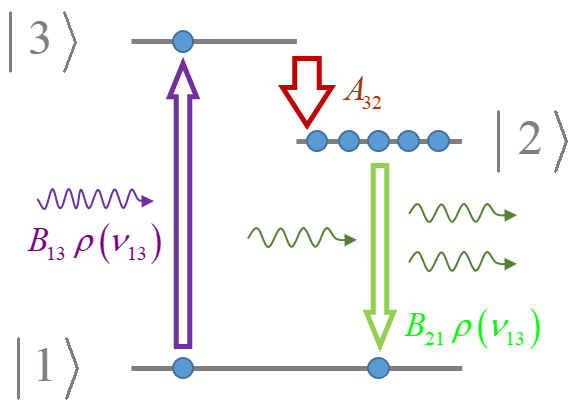
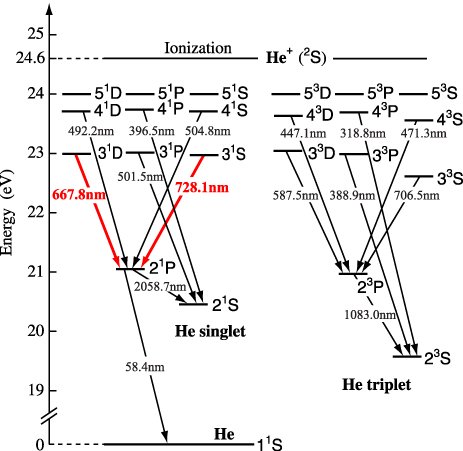




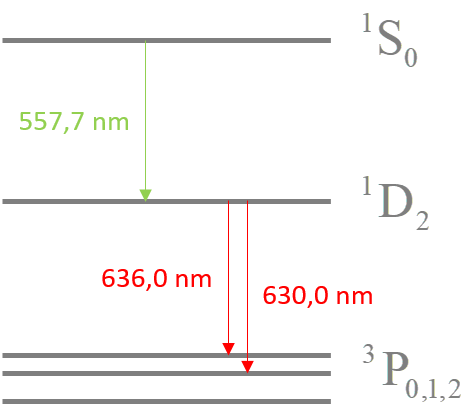



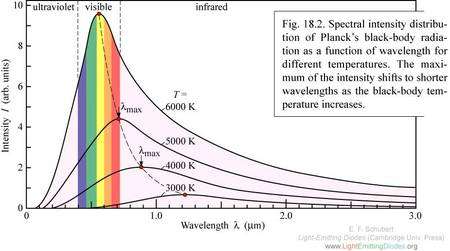
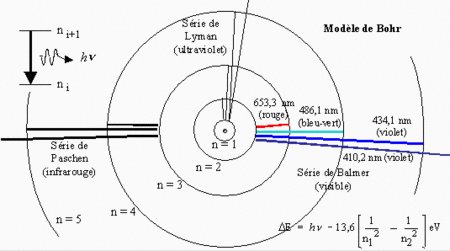
²P₃/₂ → ²S : 589.5924 nm
²P₁/₂ → ²S : 588.9950 nm

Pour l'hématite : 2 Fe₂O₃ + 3 C → 4 Fe + CO₂


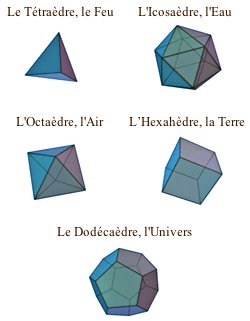
💧 eau = froide + humide
🌳 terre = froide + sèche
🔥 feu = chaud + sec
🌬️ air = chaud + humide




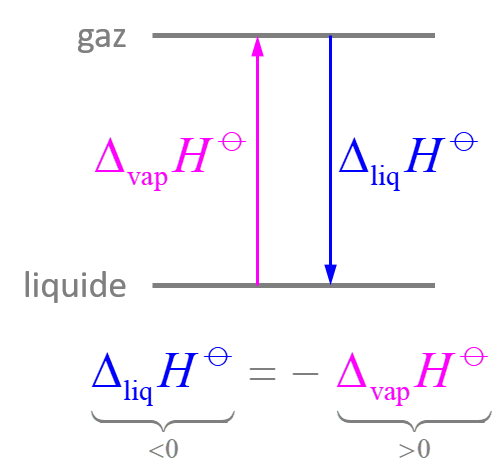
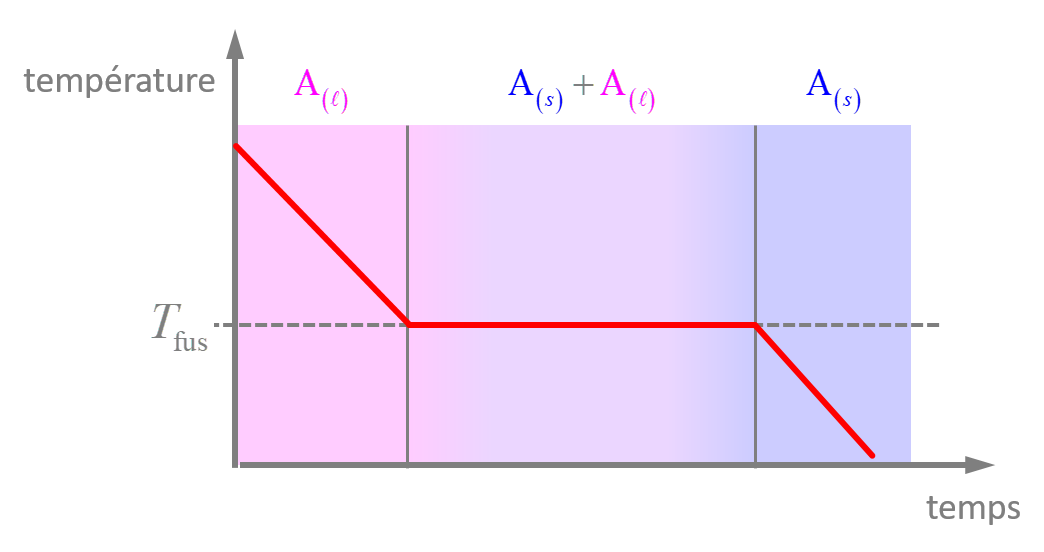
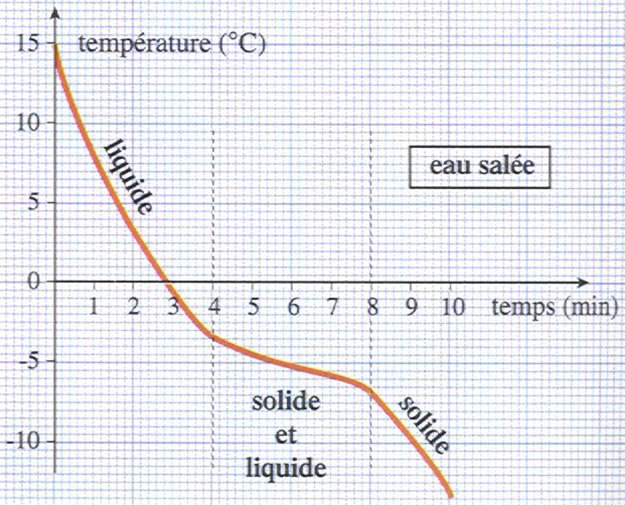


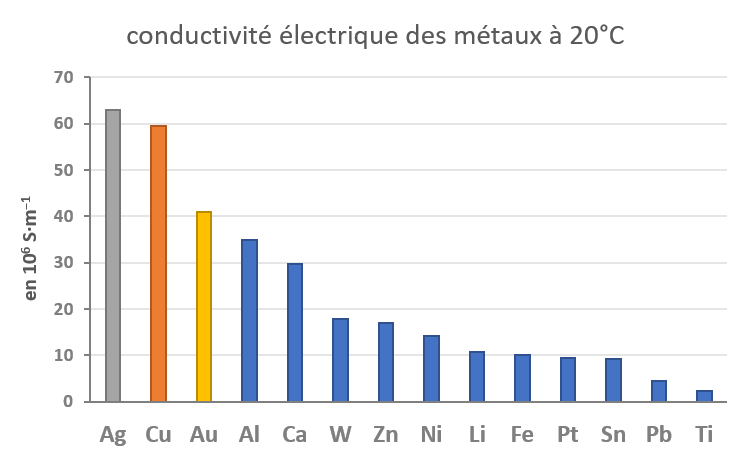




Même son surnom "Paracelse", littéralement "au-delà de Celsus", médecin romain de renom
🜍 soufre : actif, chaud, dur
☿ mercure : passif, froid, volatile
🜔 sel : solidité passive, cohésion
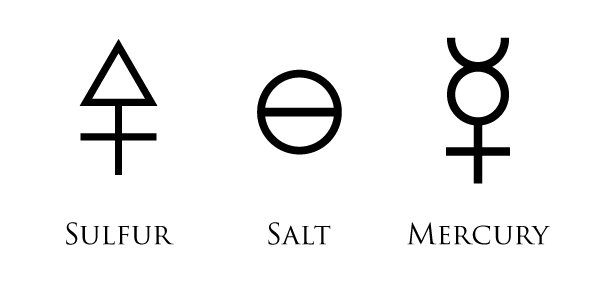

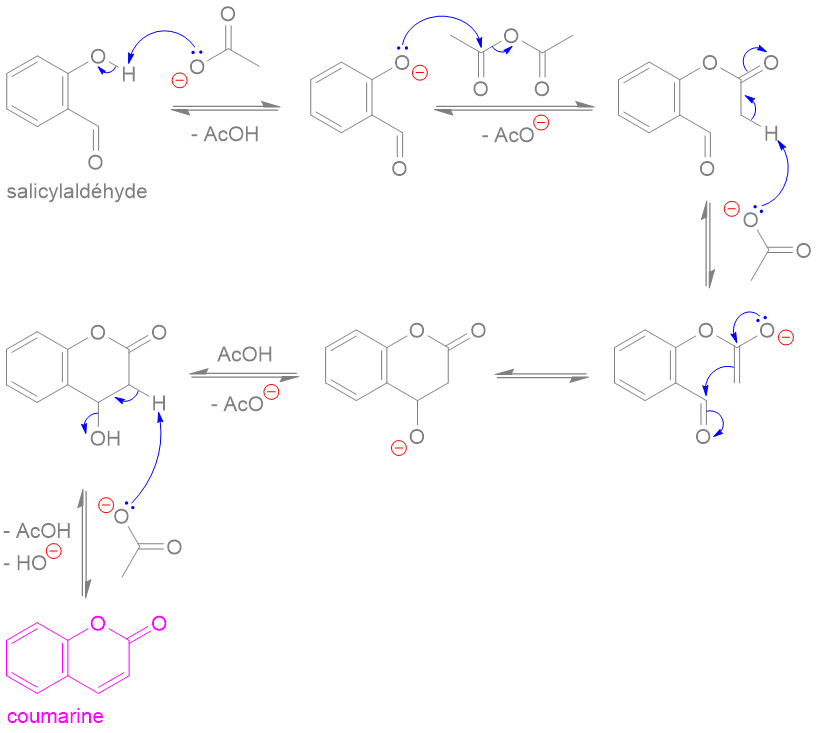





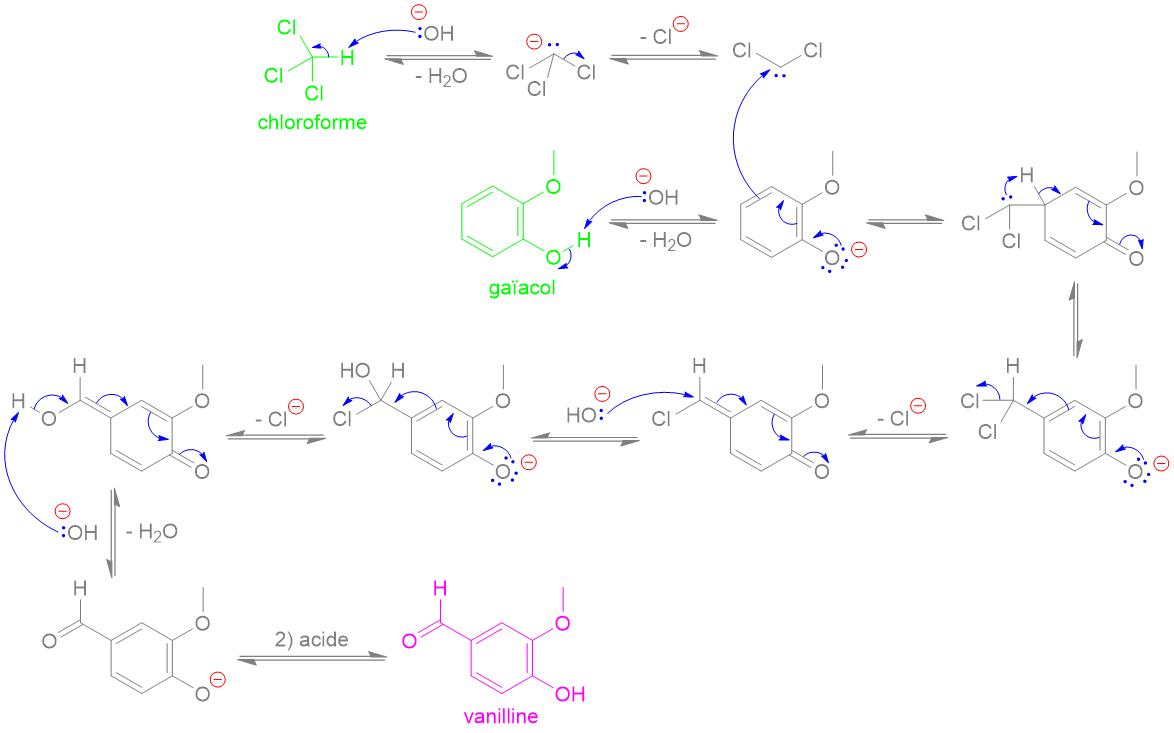


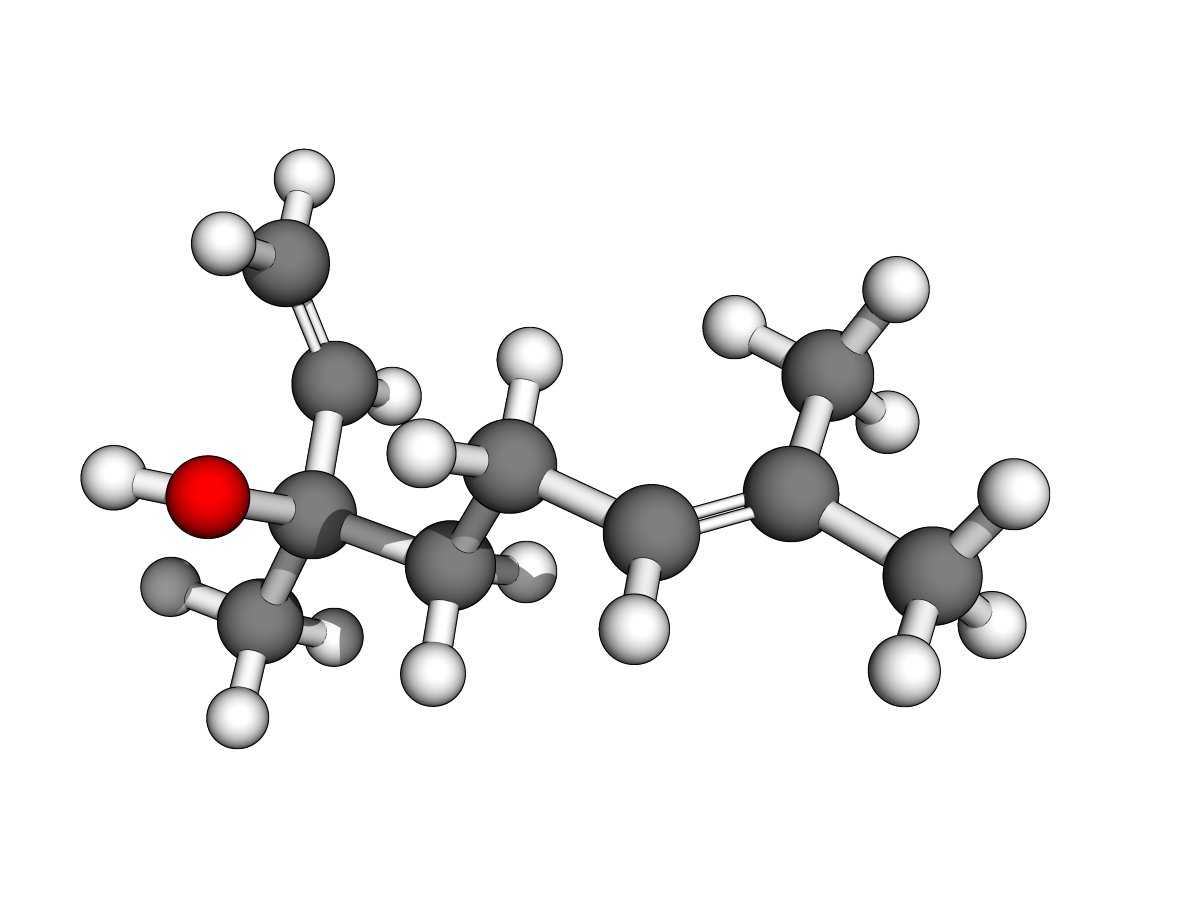
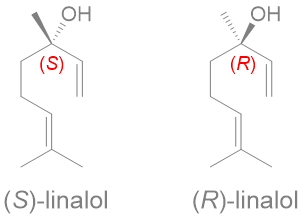


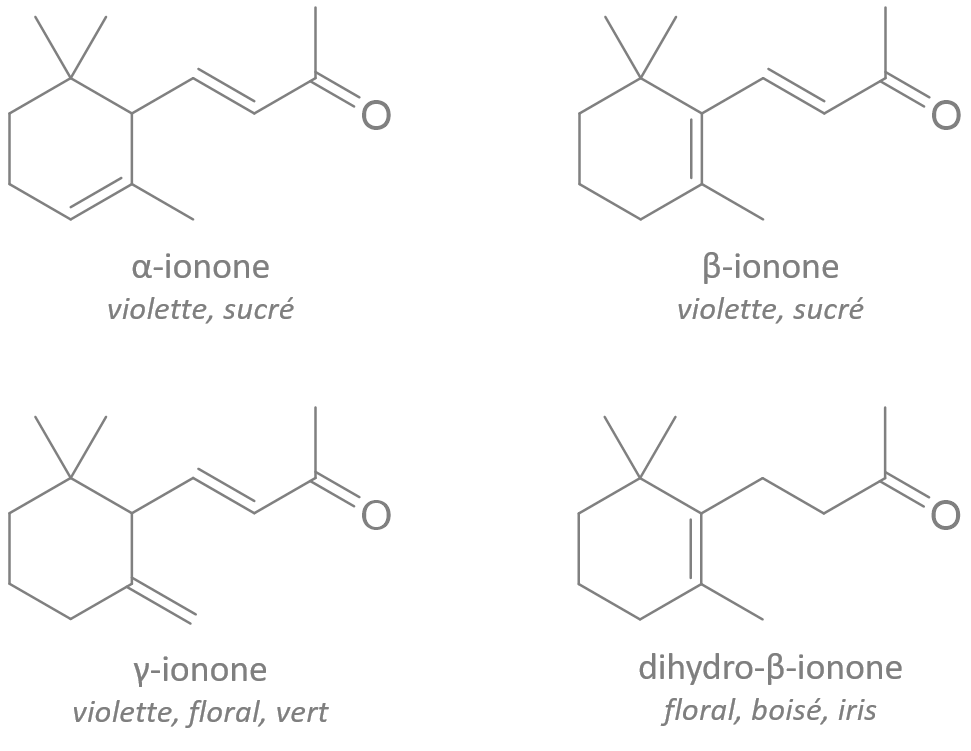
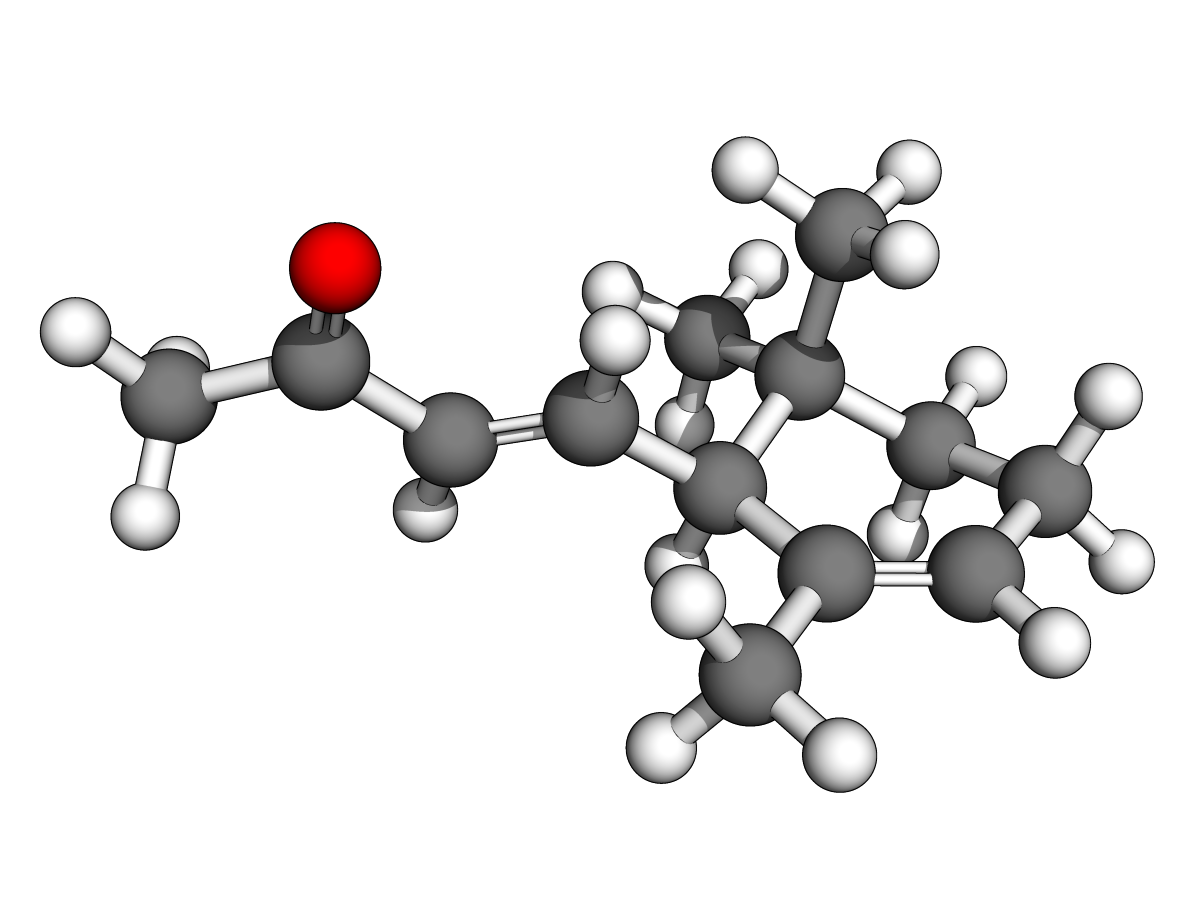
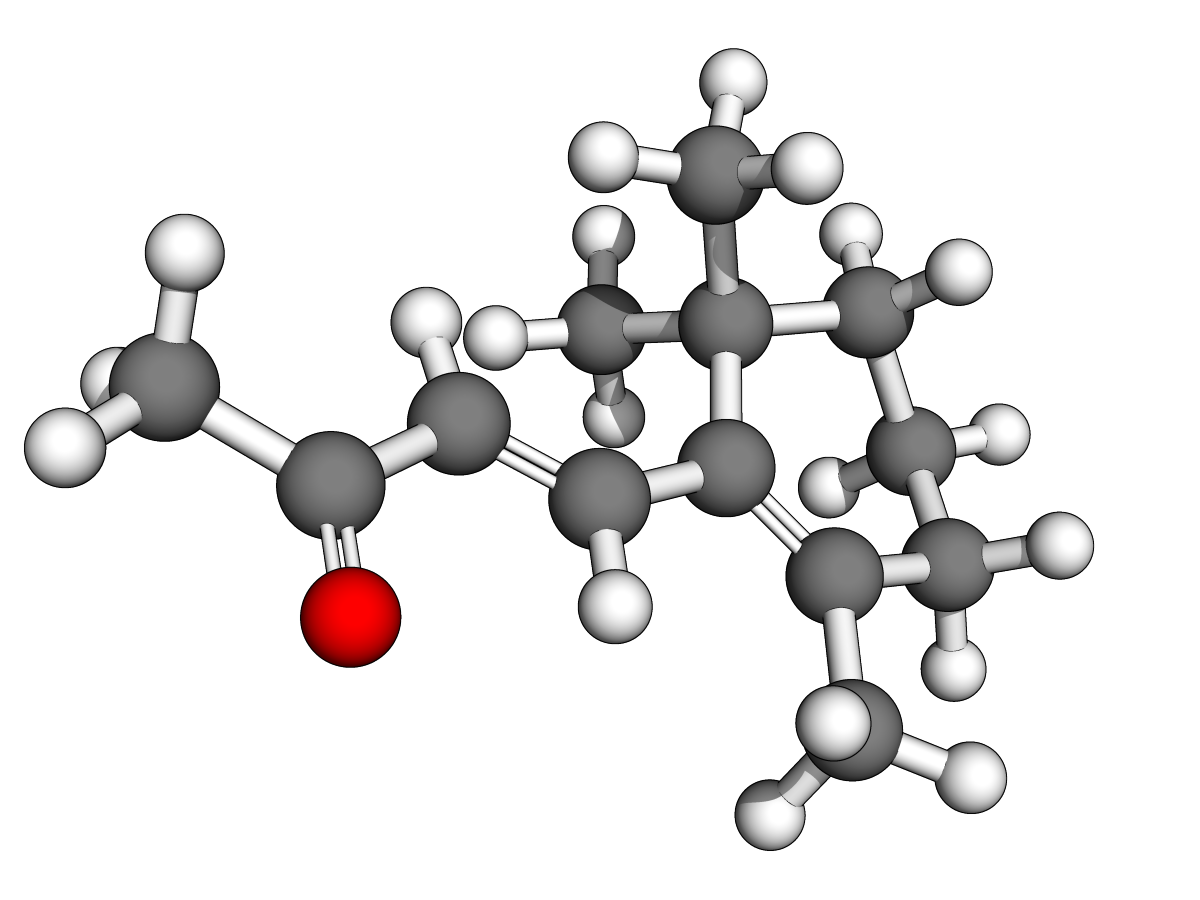
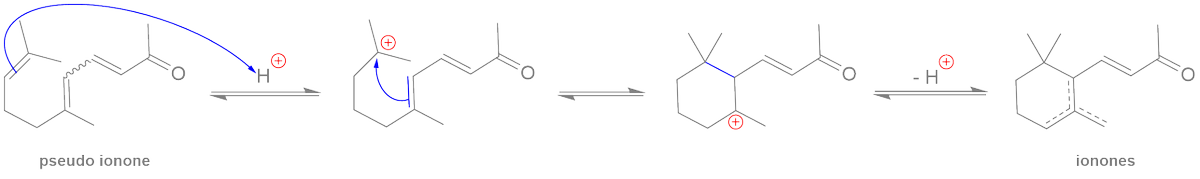









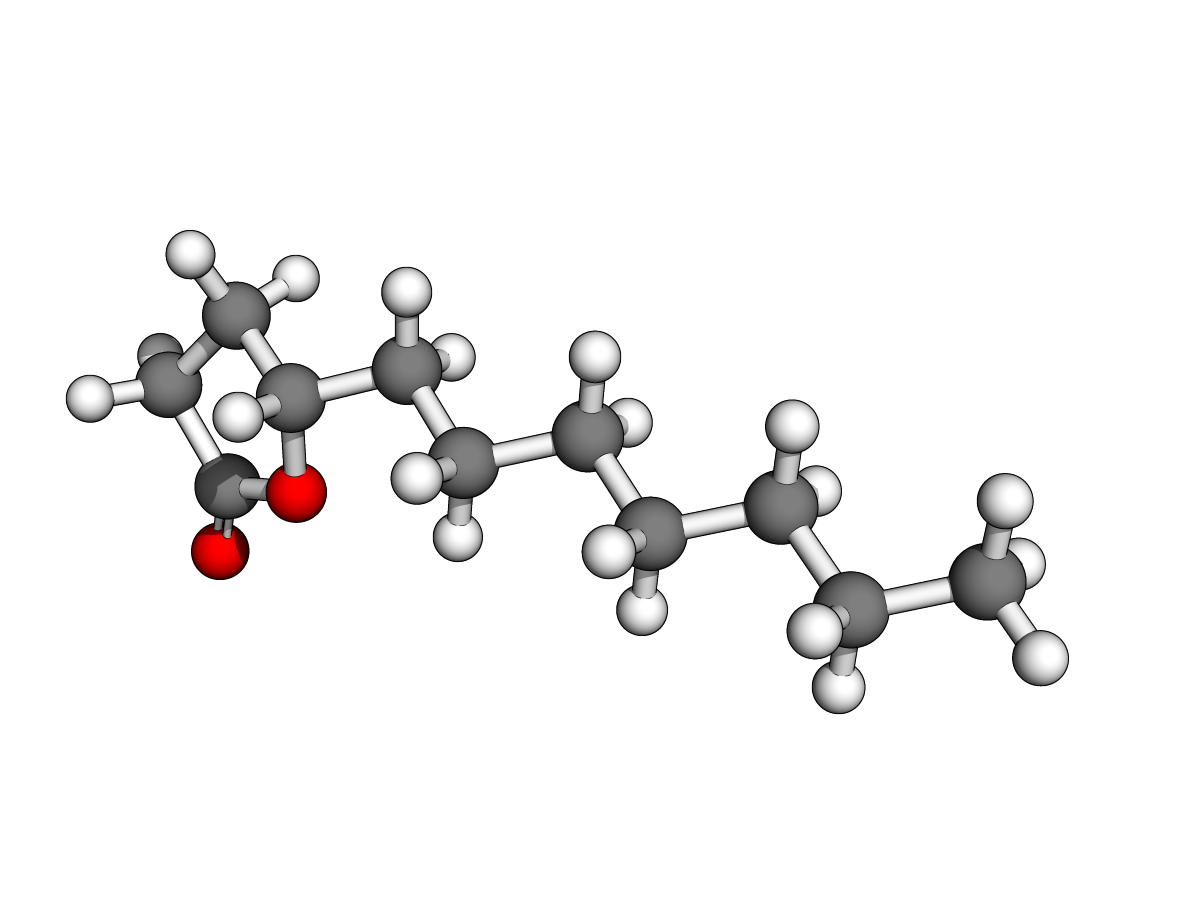



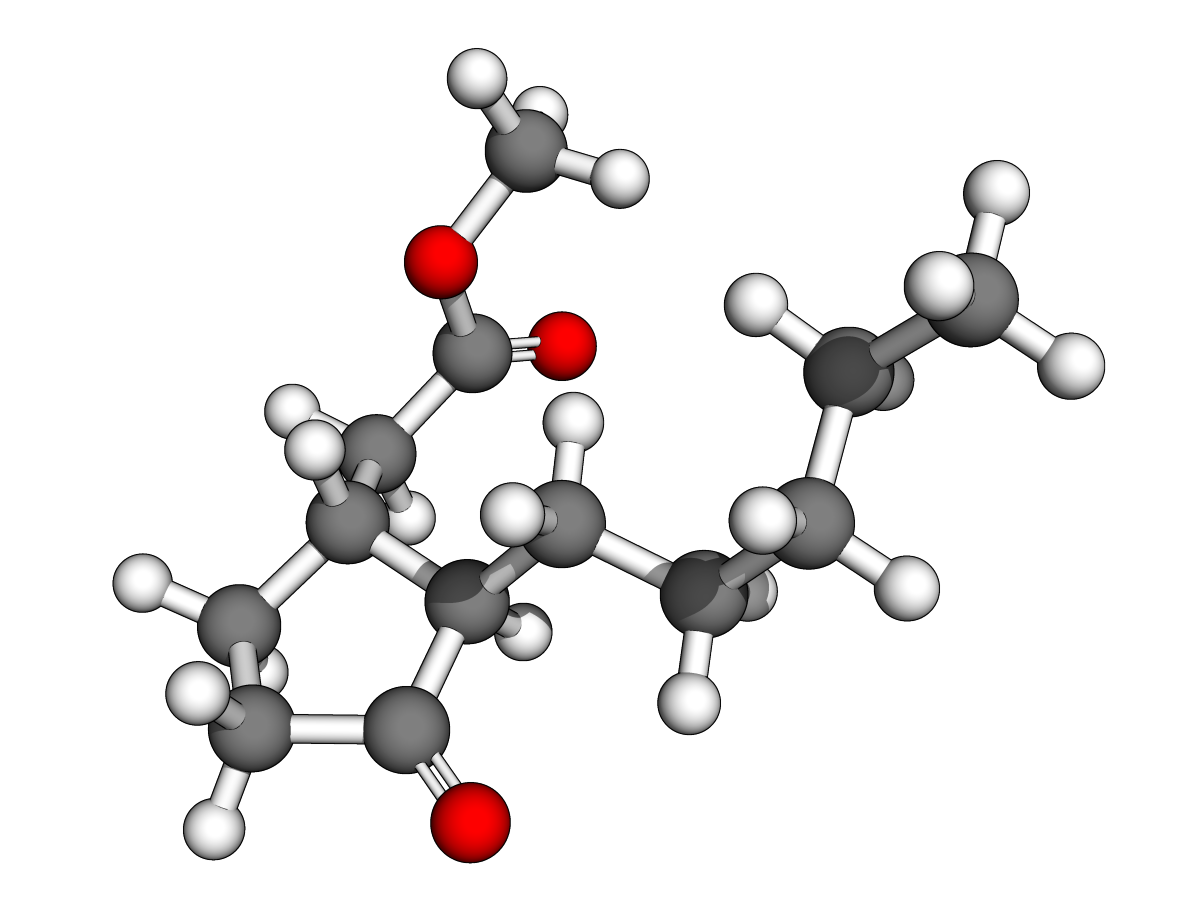
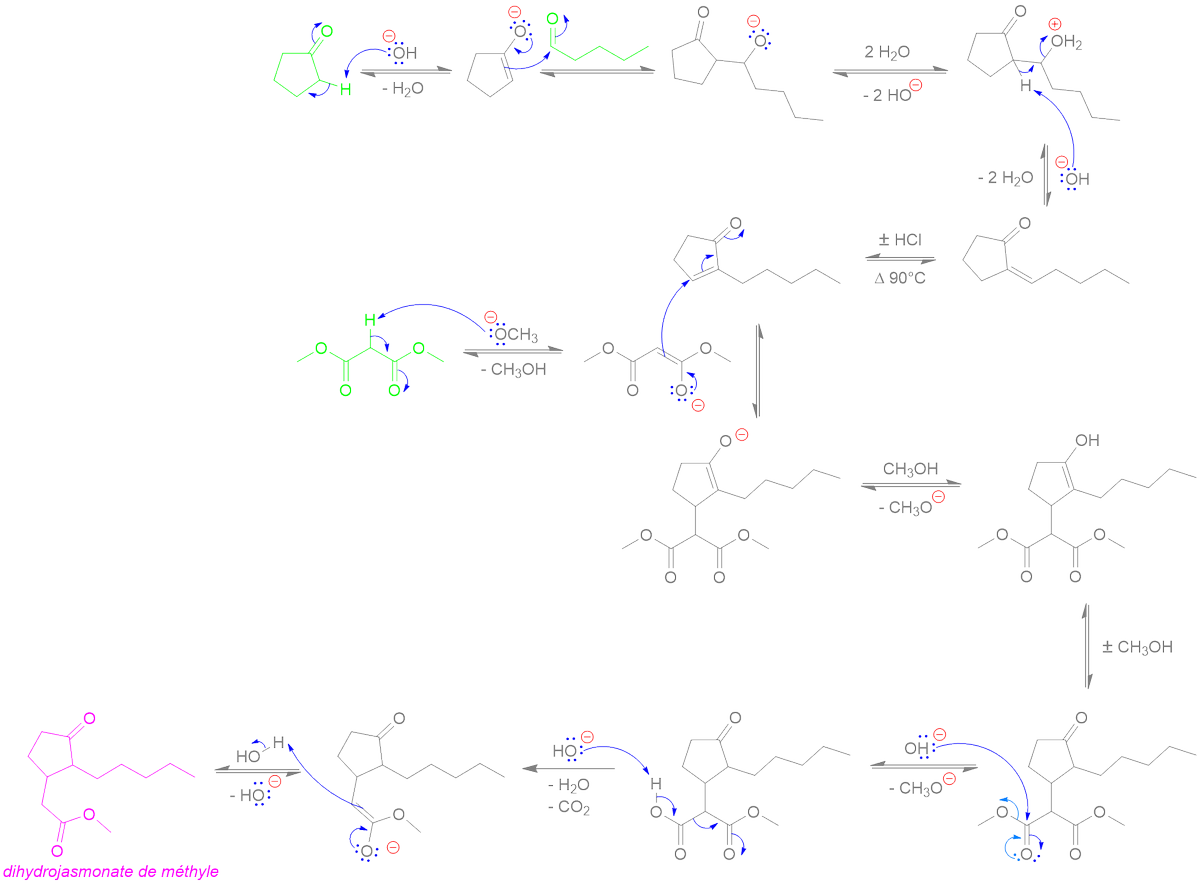

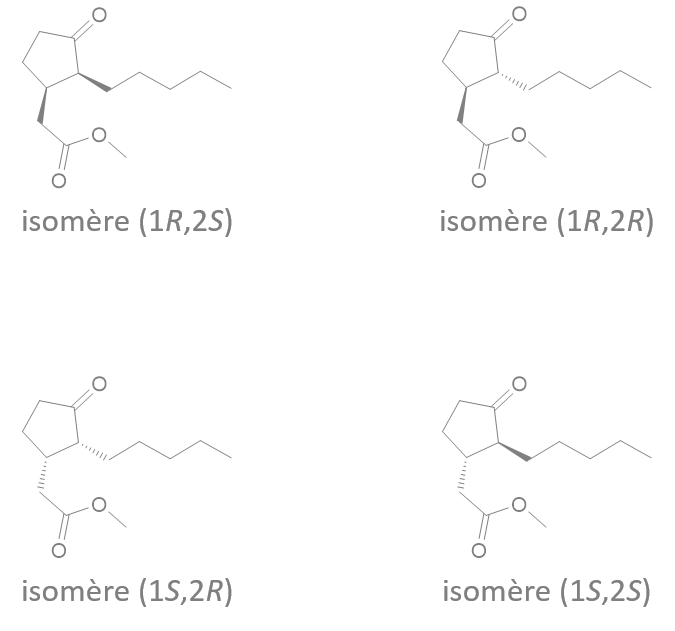
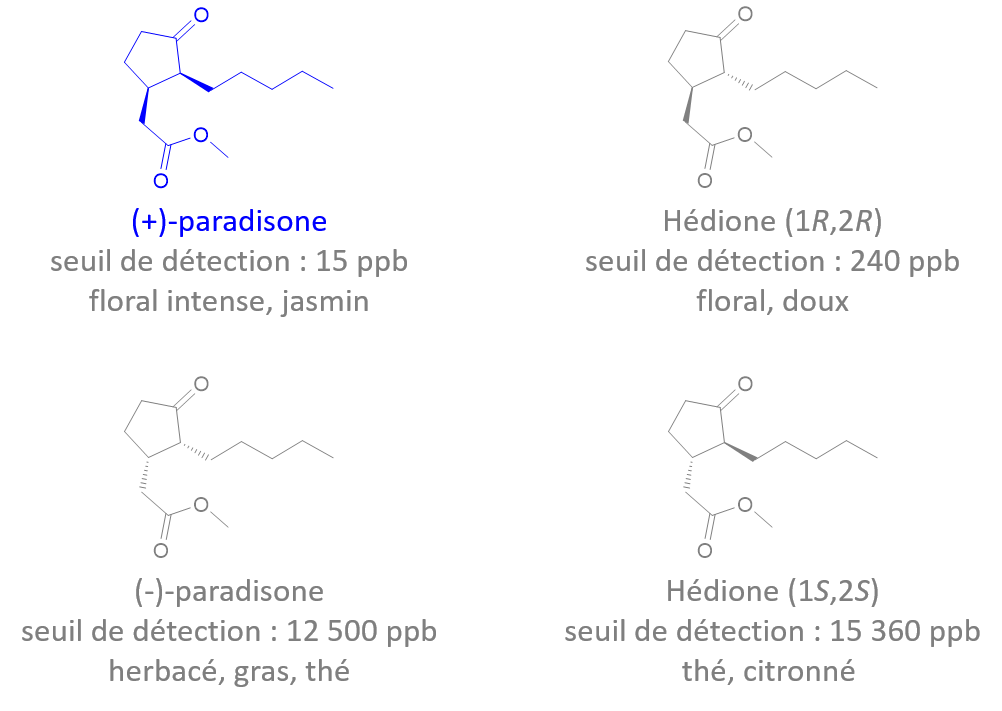
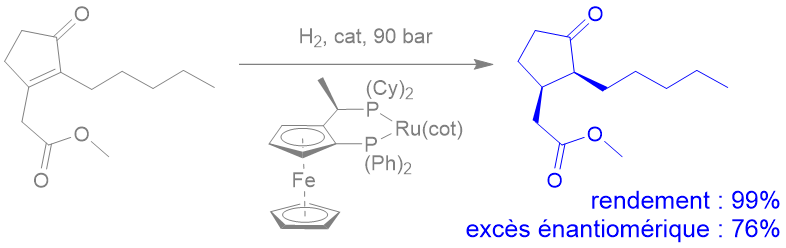
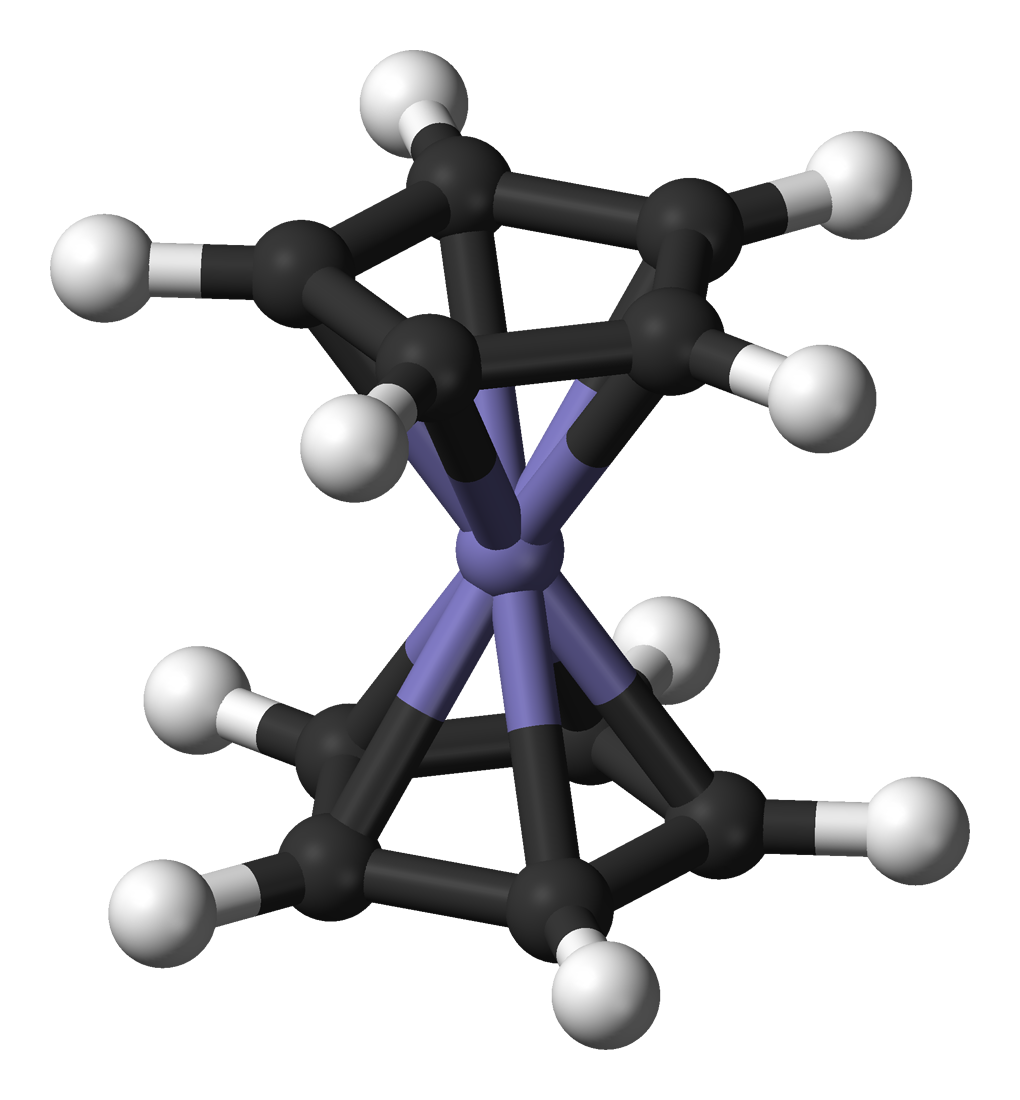
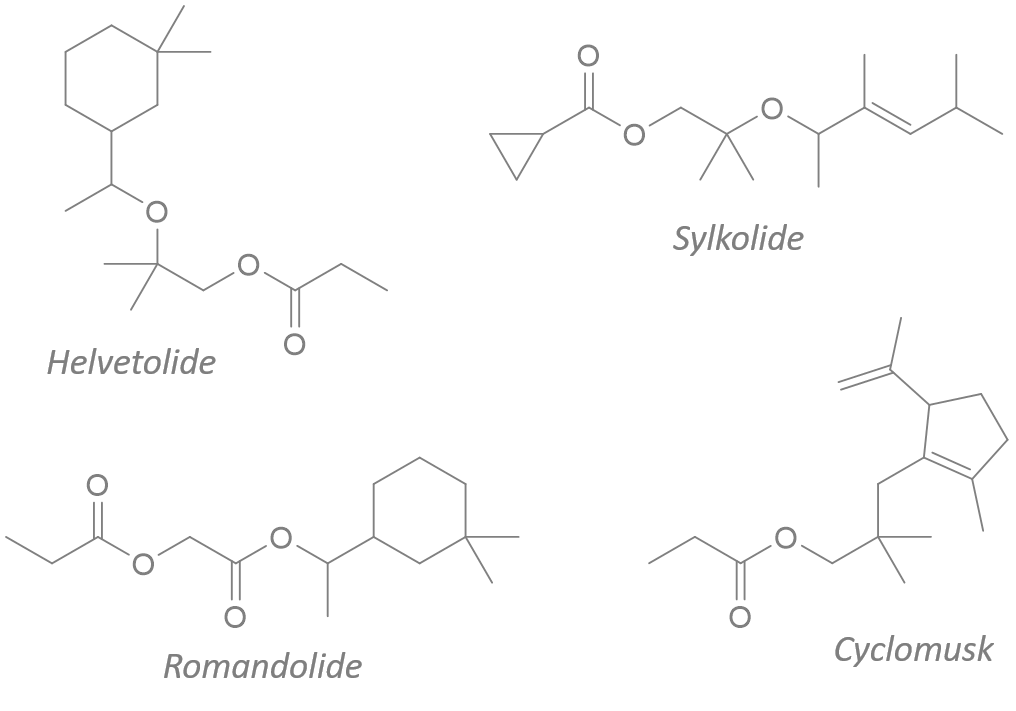
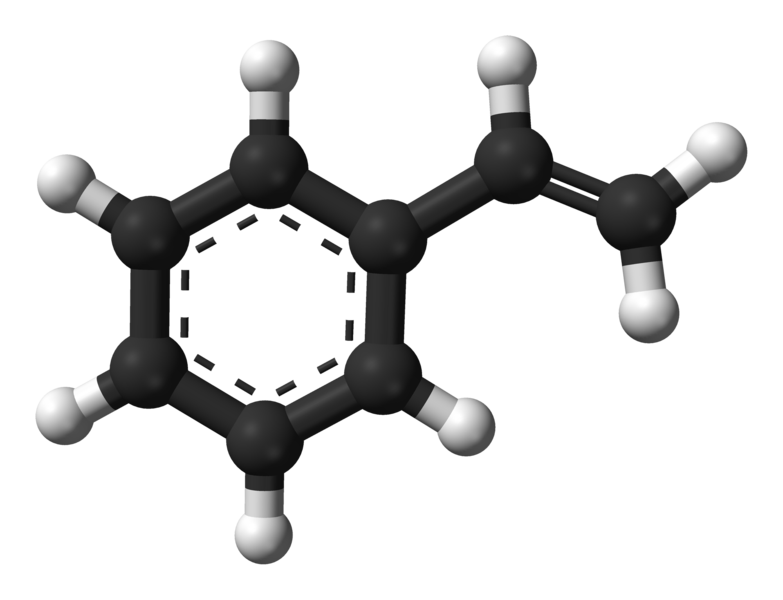
Ph = "phenyl"
Cy = "cyclohexyl"
cot = "cyclooctatetraenyl"

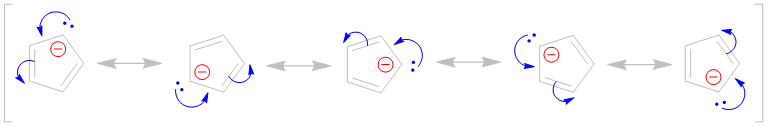
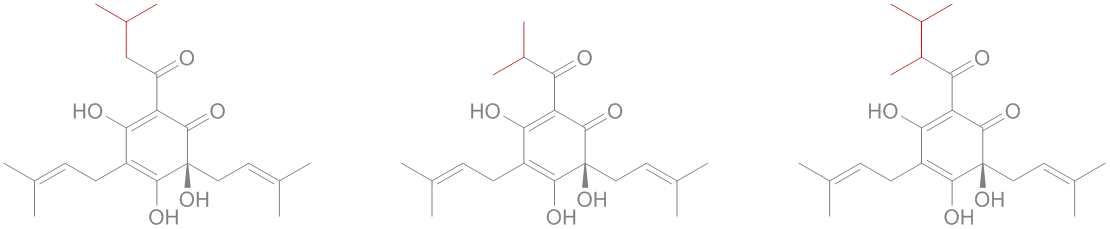
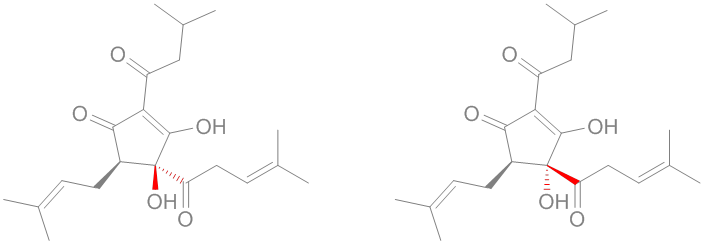
sciencedirect.com/science/articl…
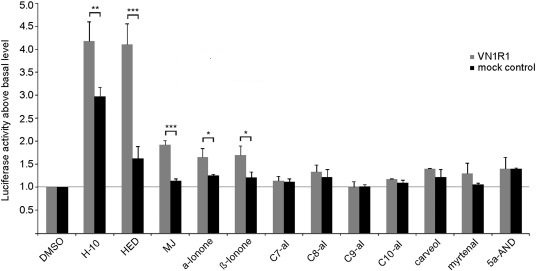


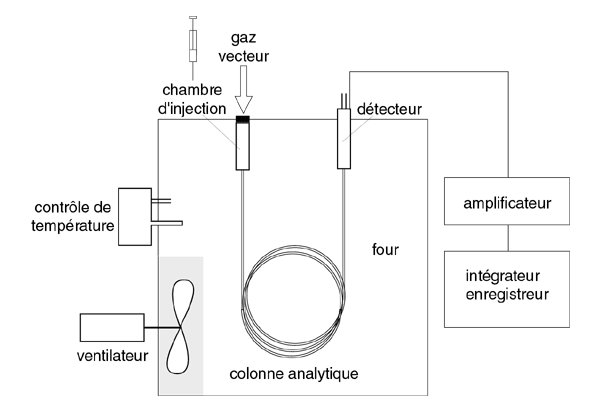
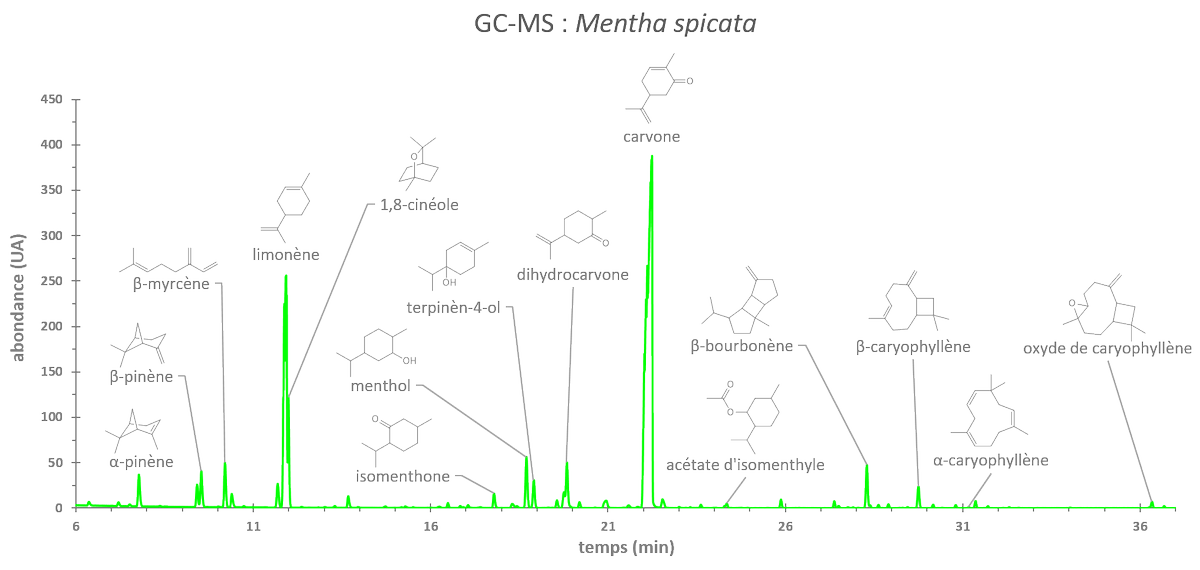
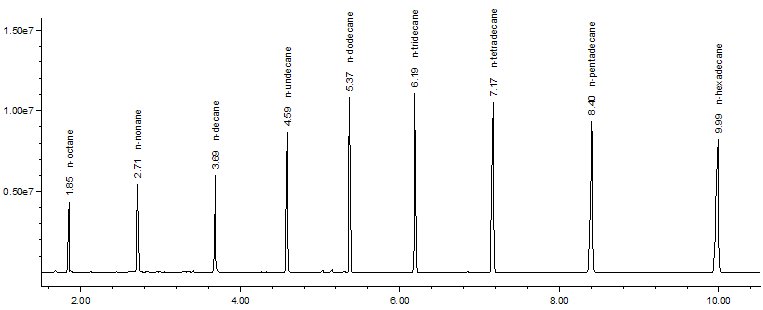
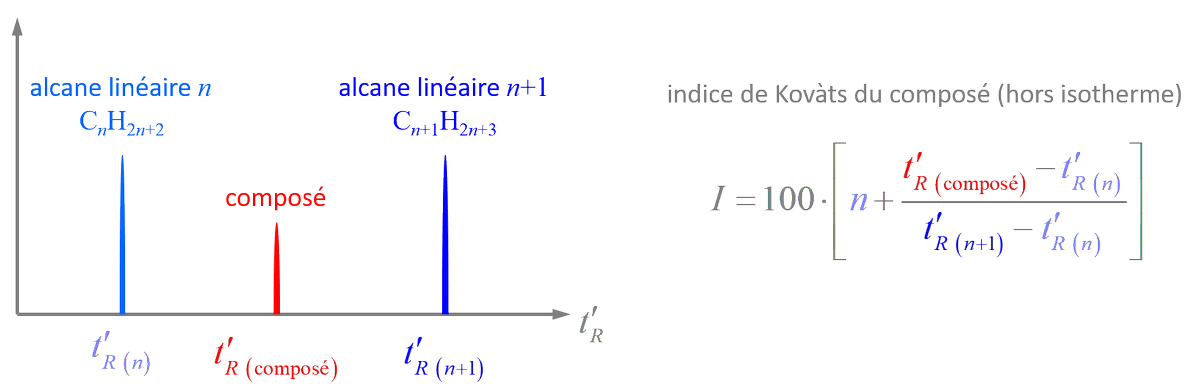
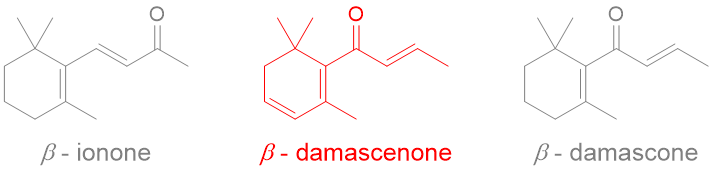
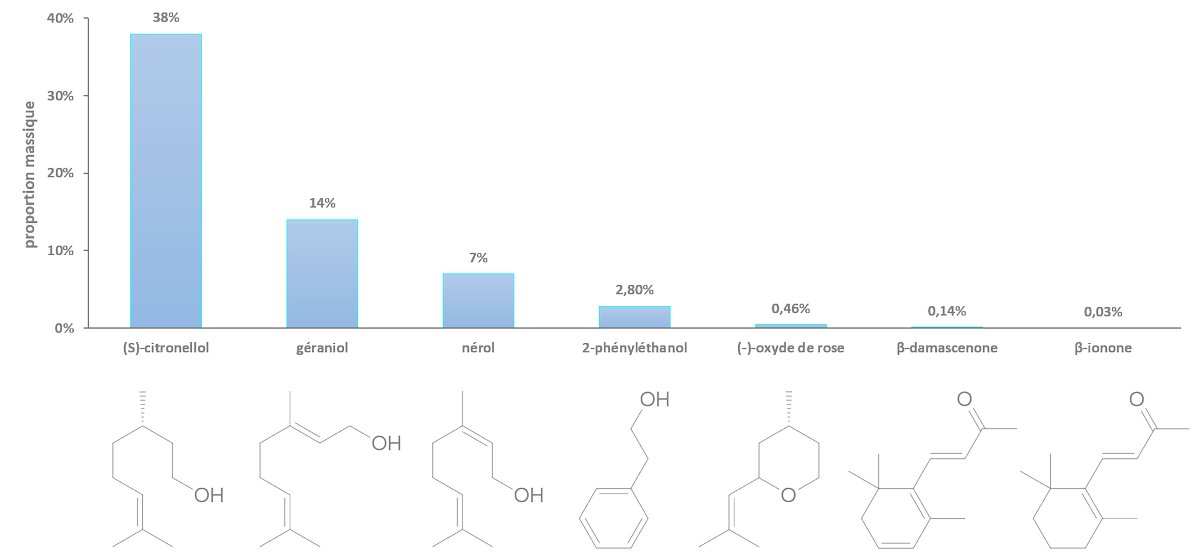
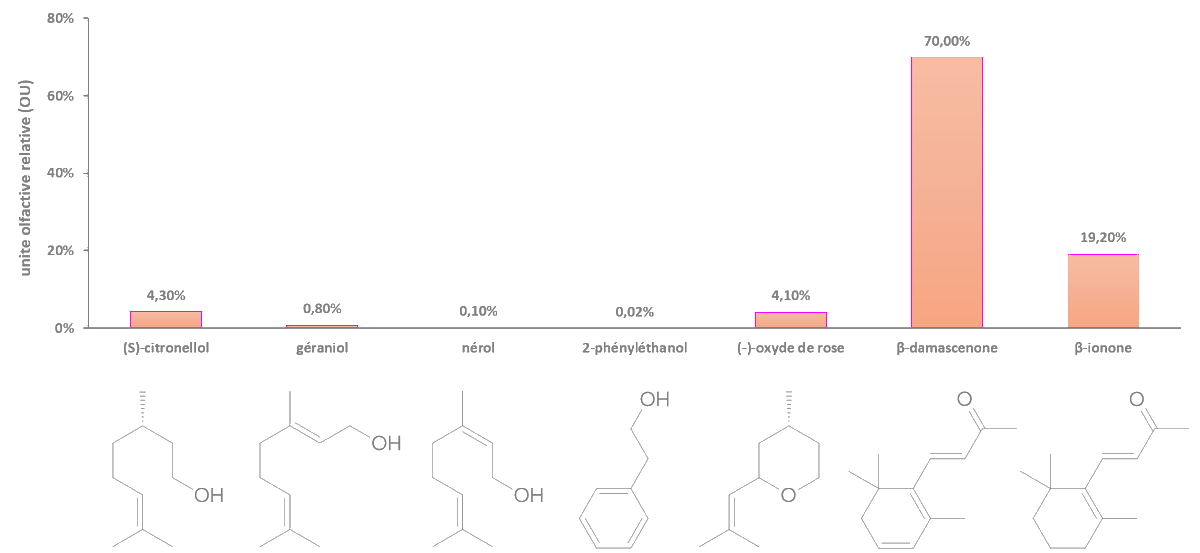
link.springer.com/article/10.100…

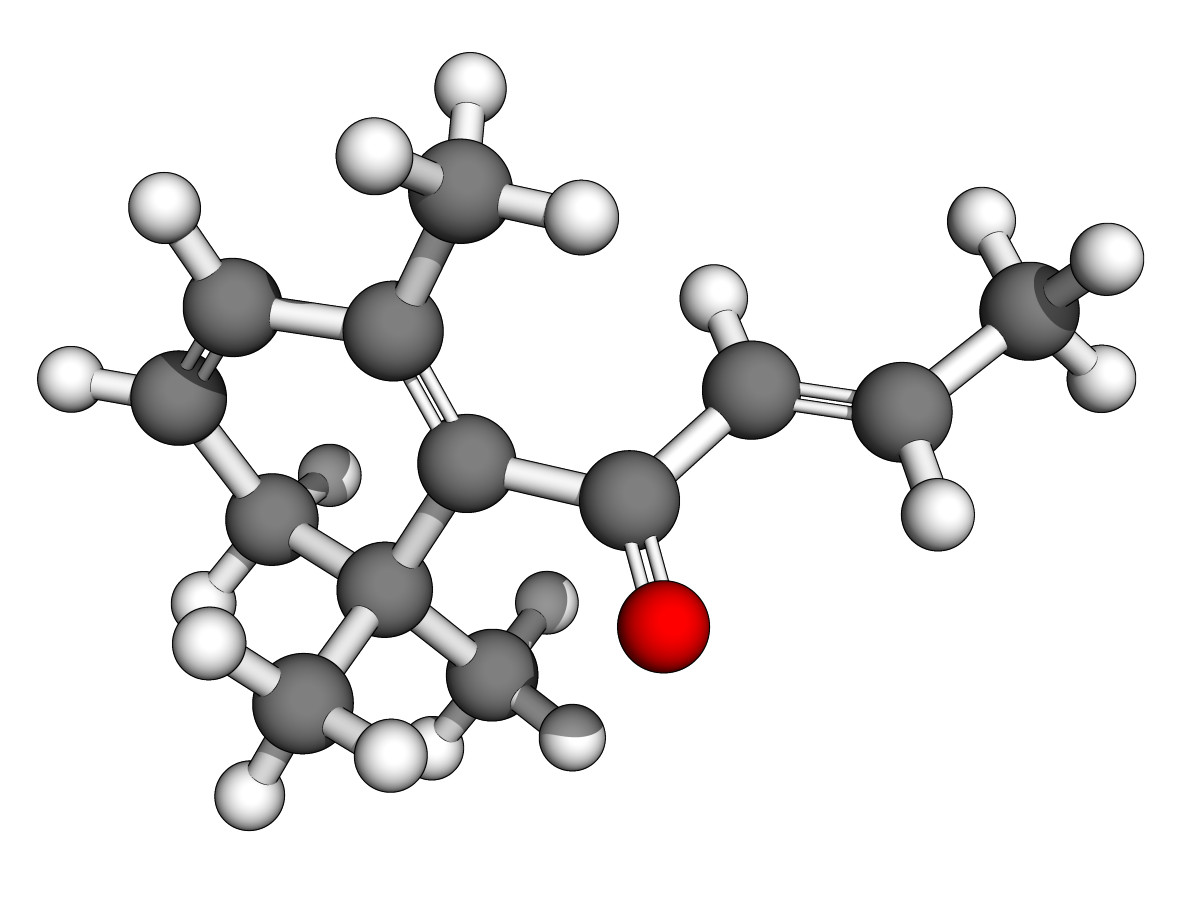
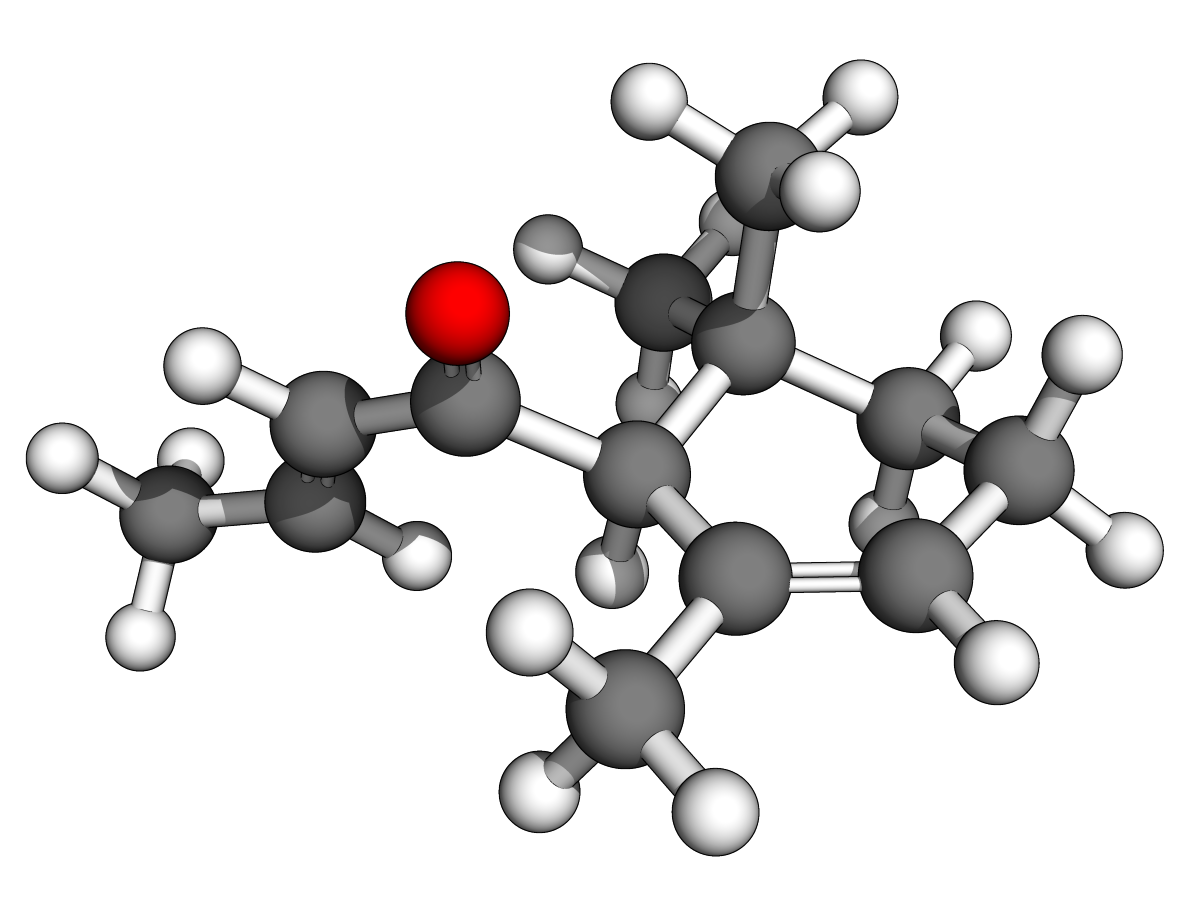
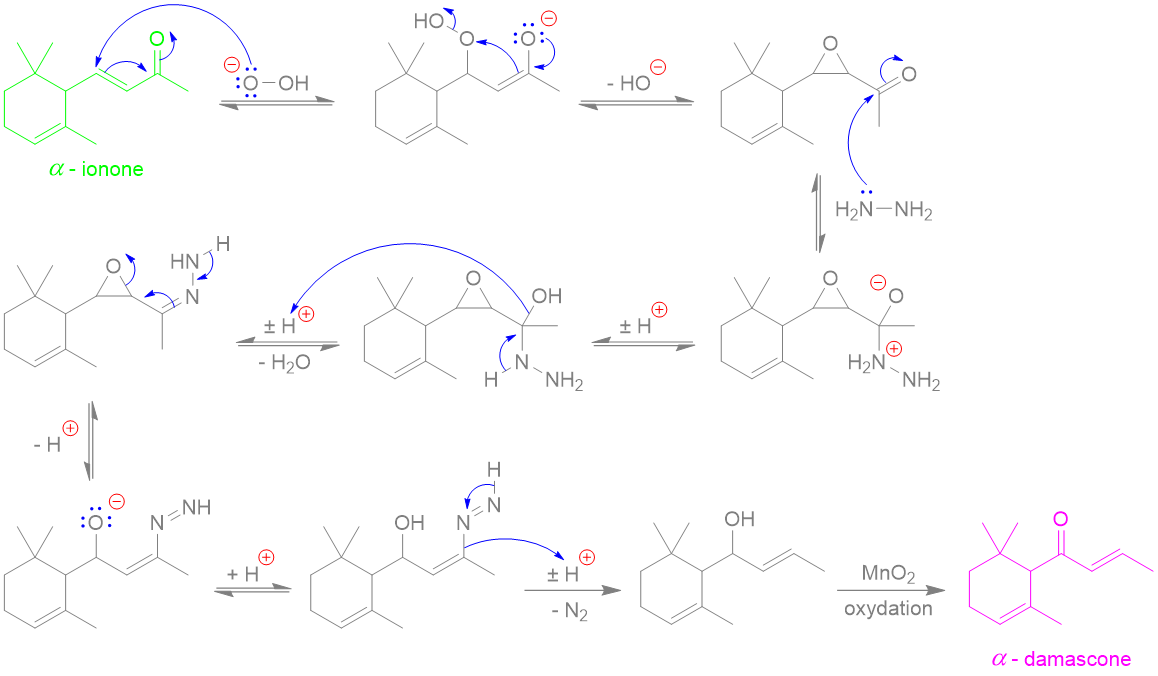
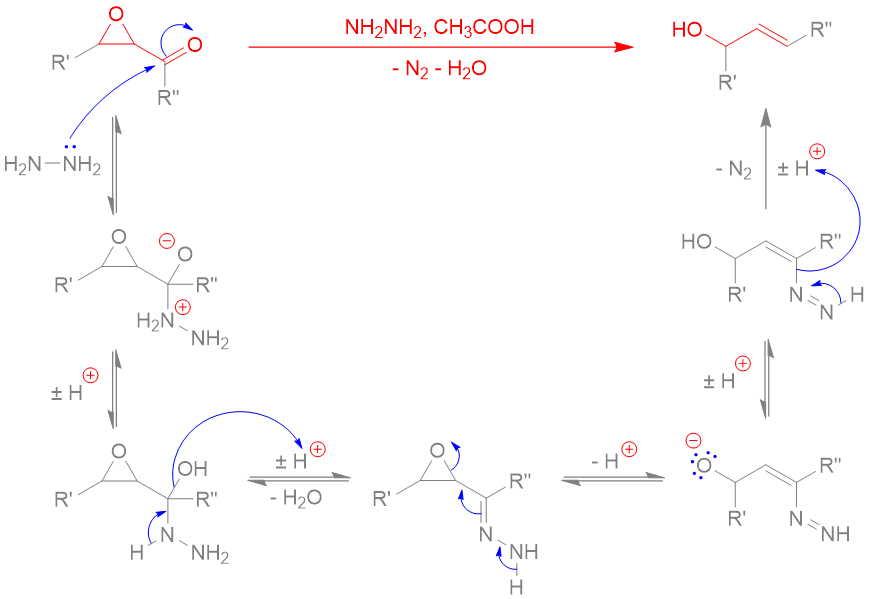


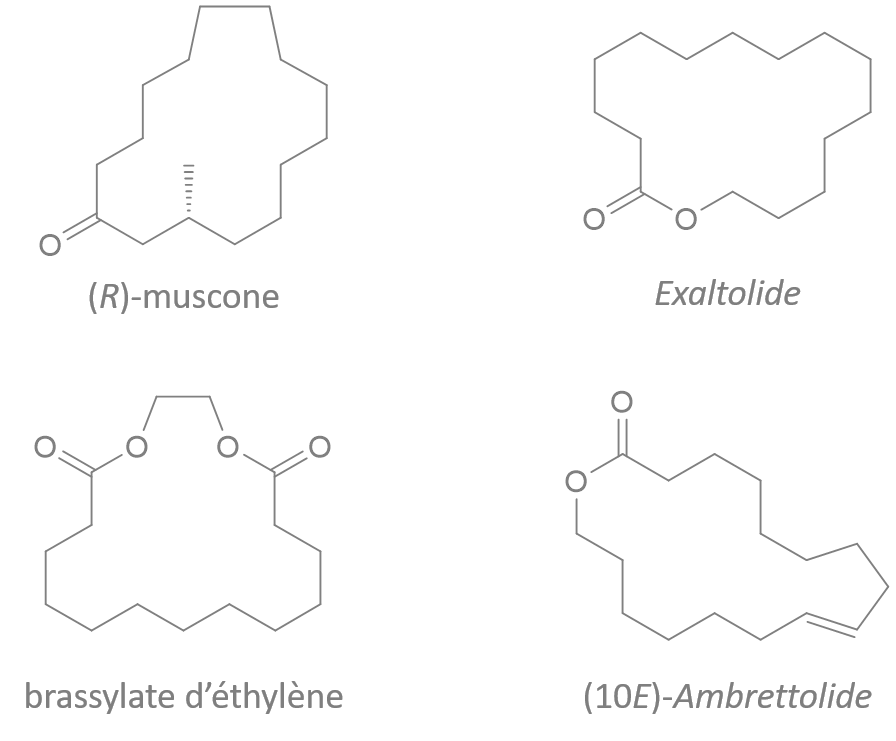



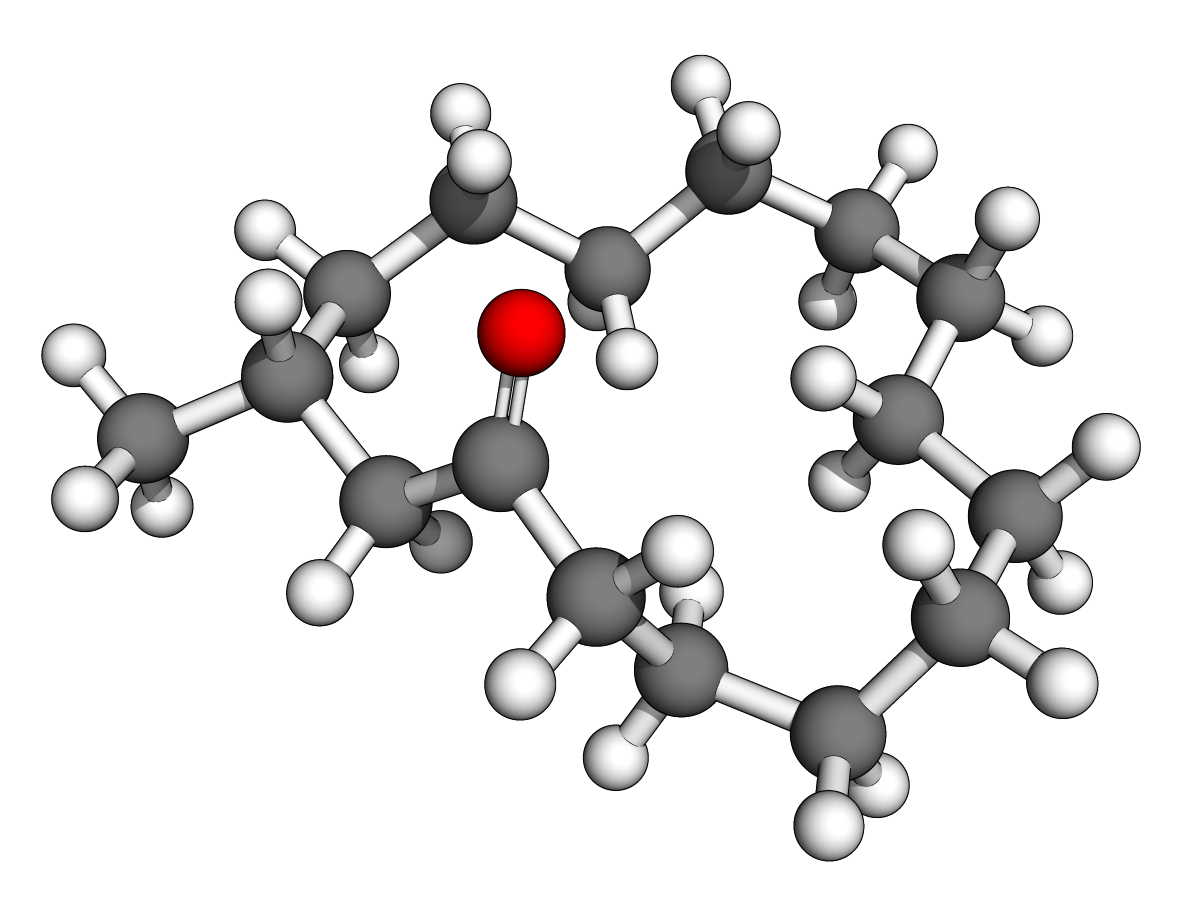
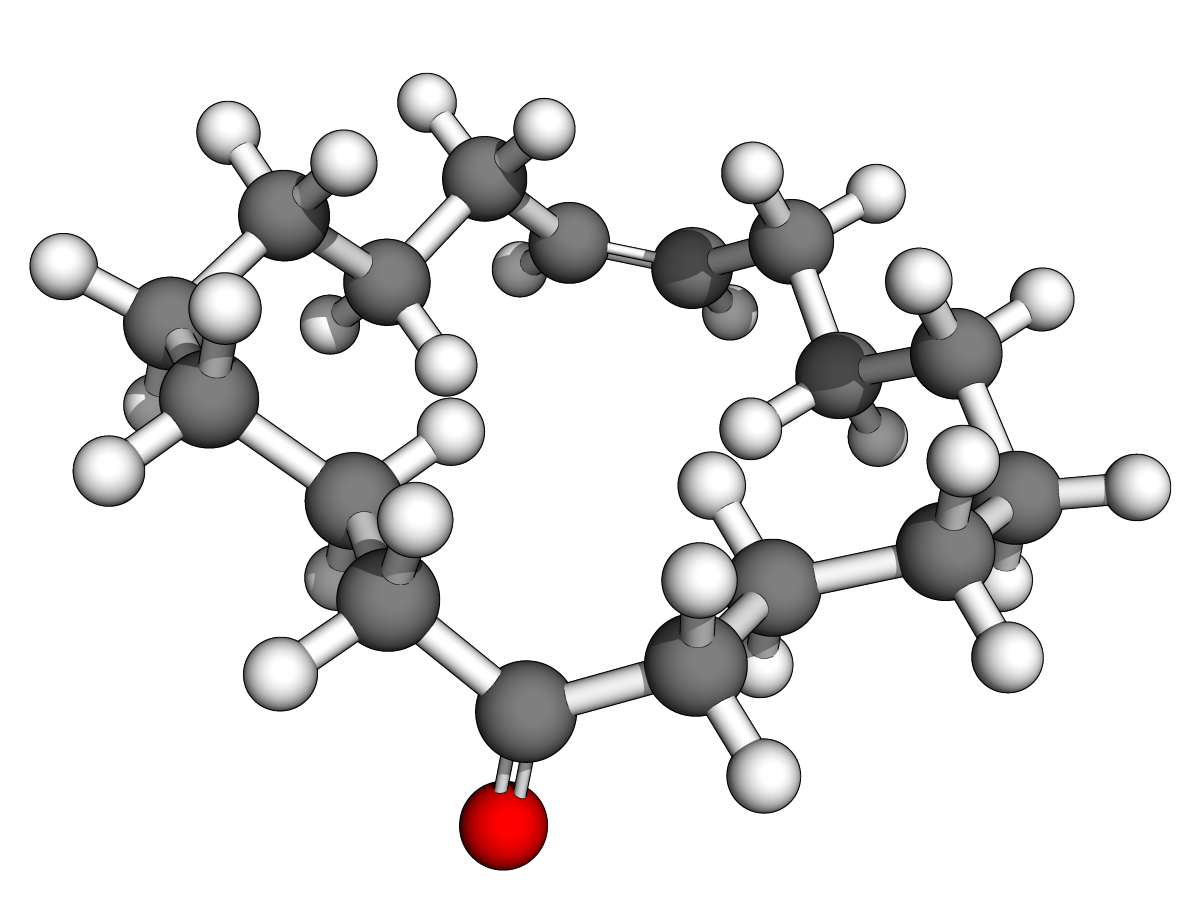
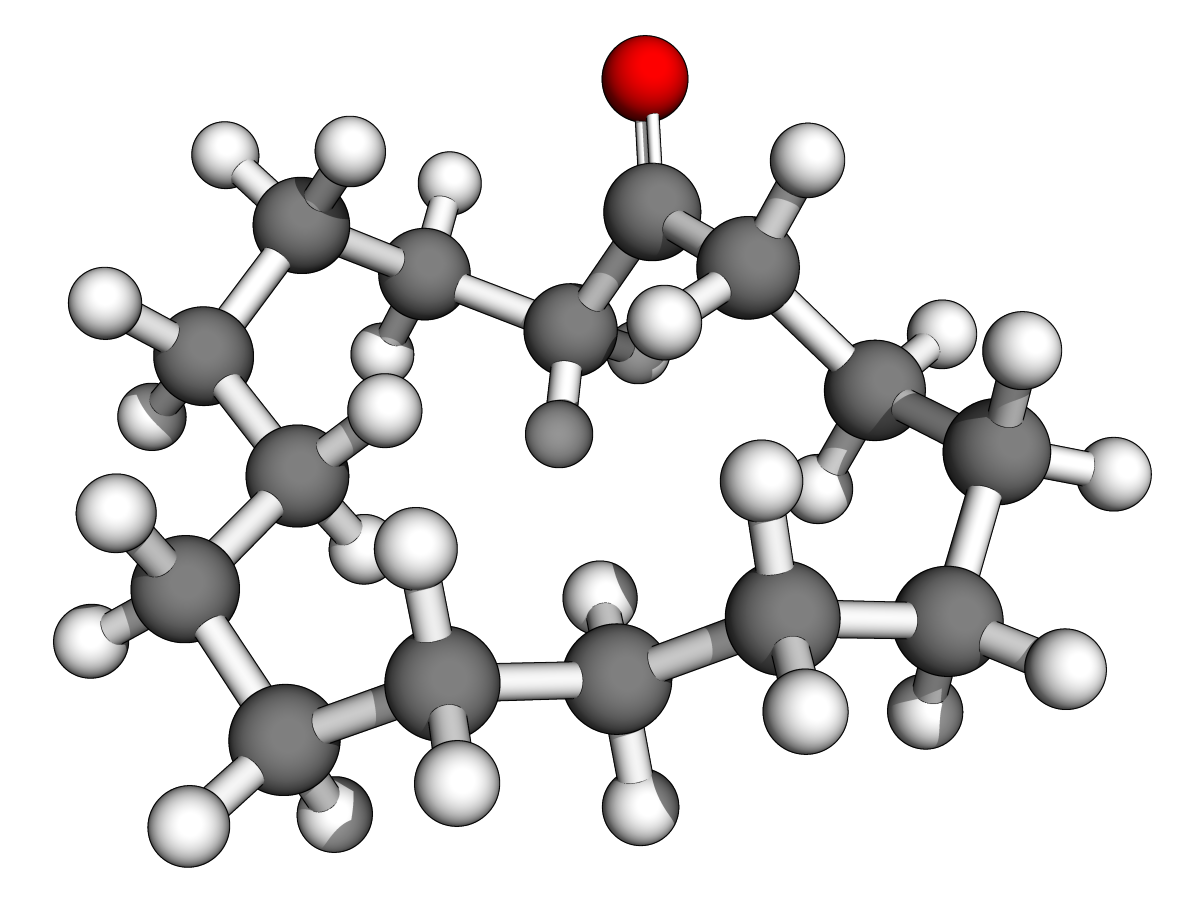
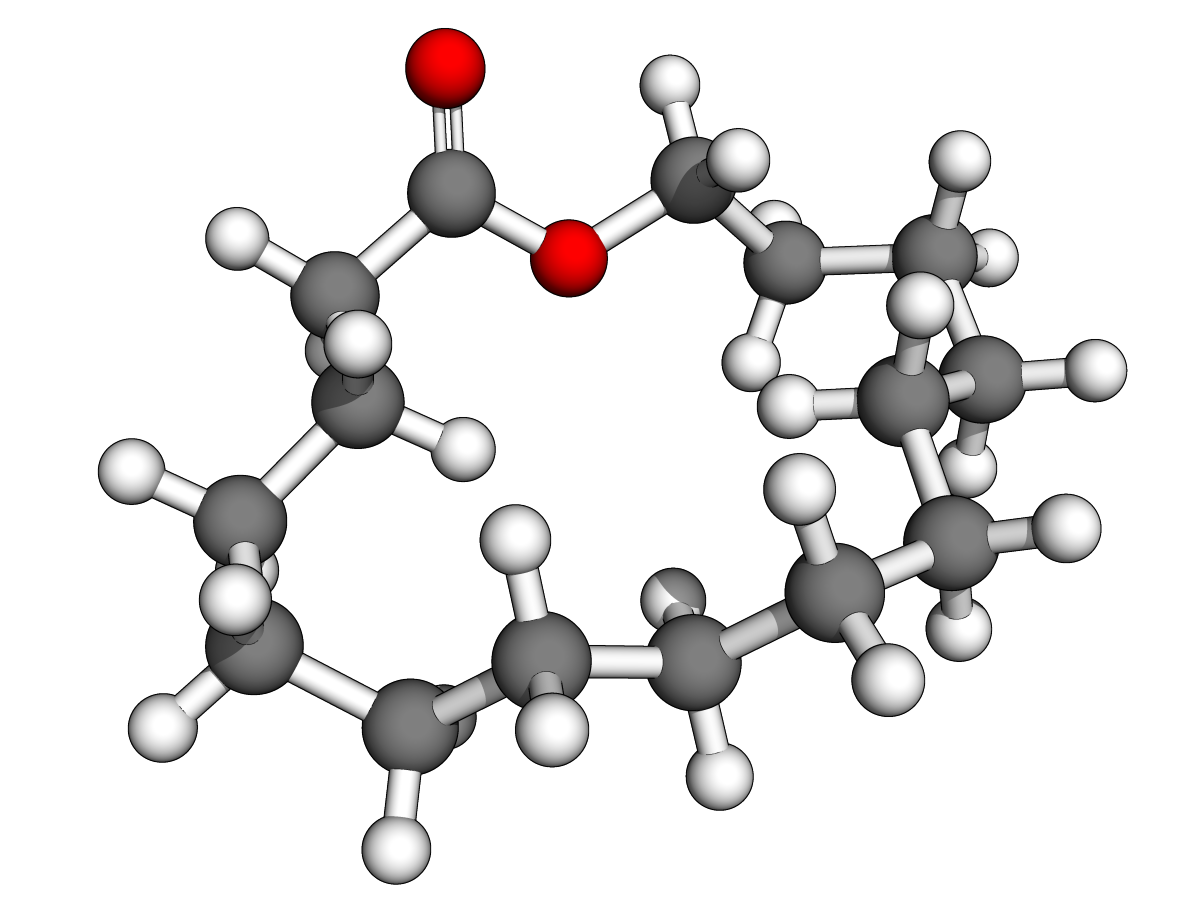

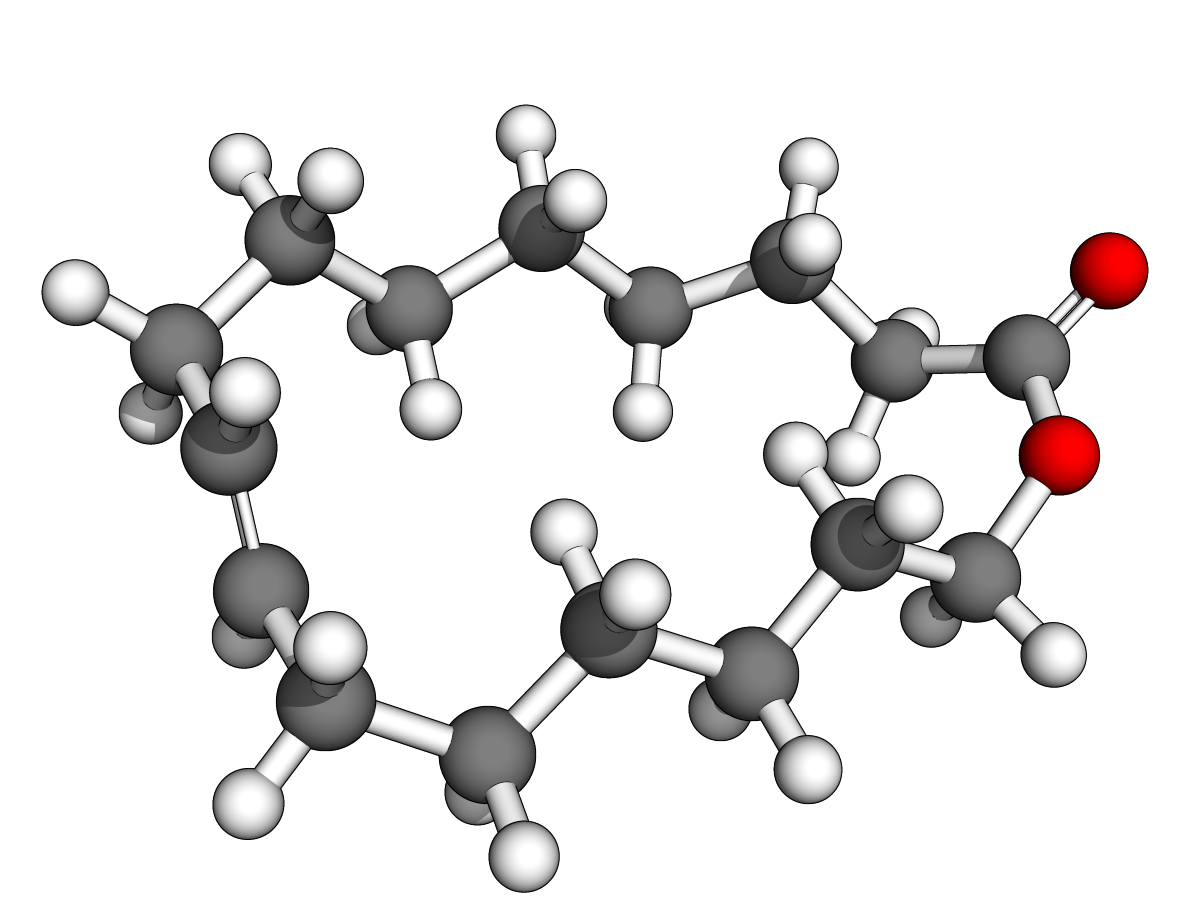
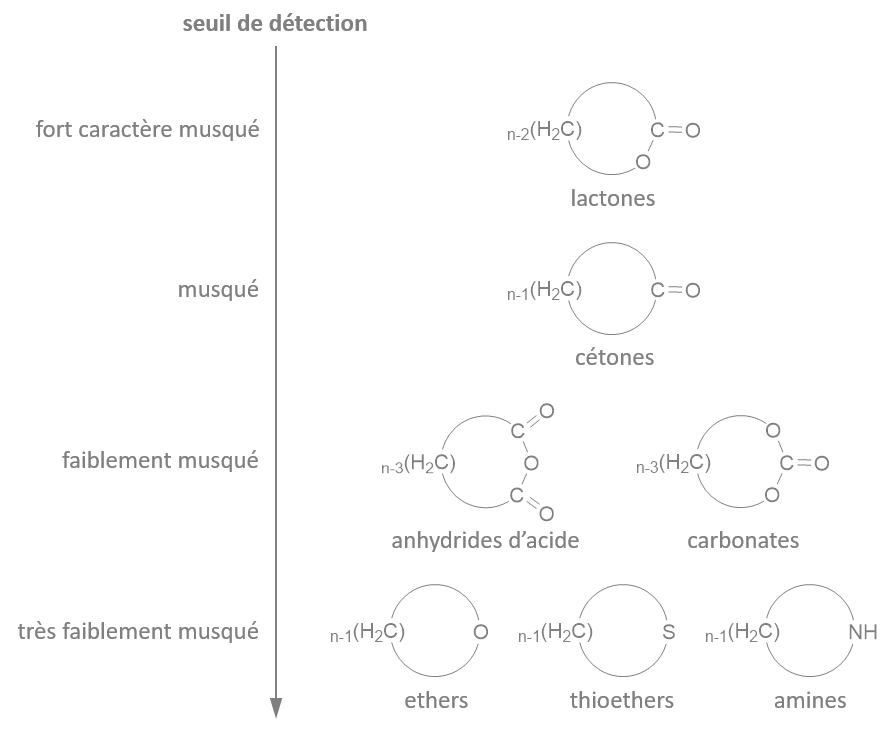
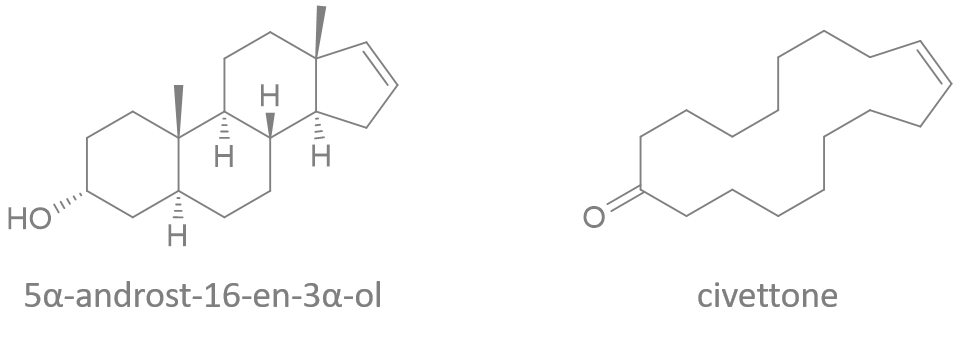
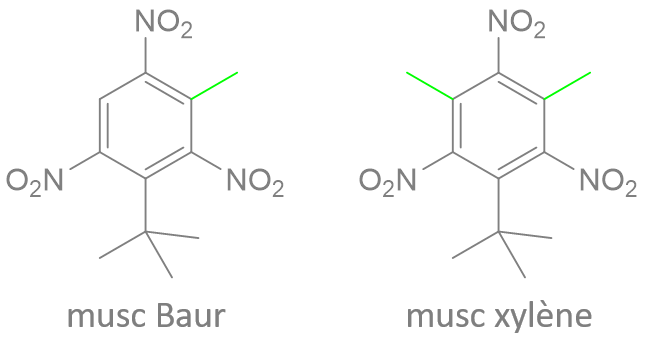
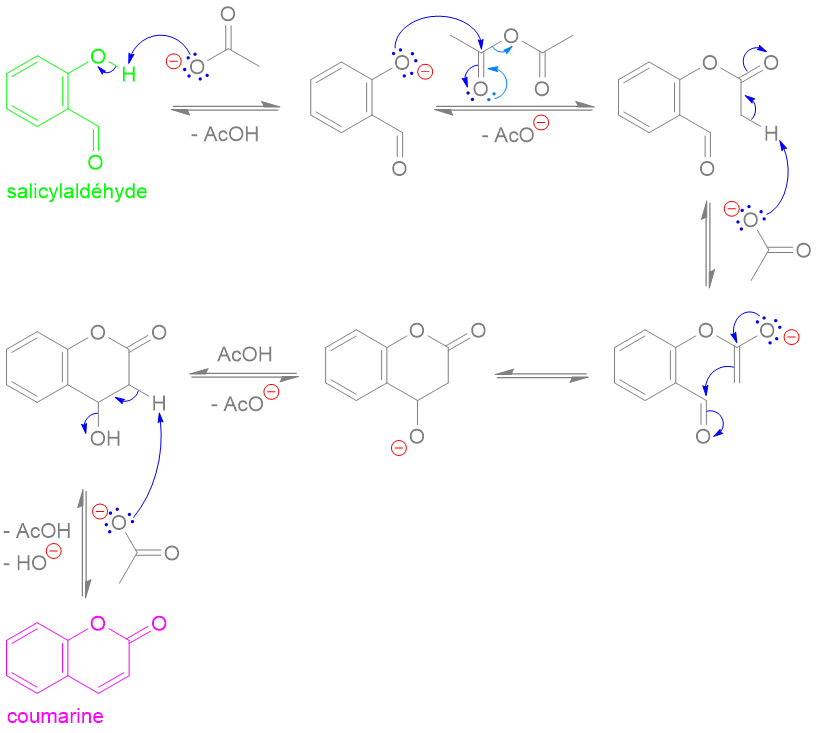
(Z)-oxacycloheptadéc-8-èn-2-one
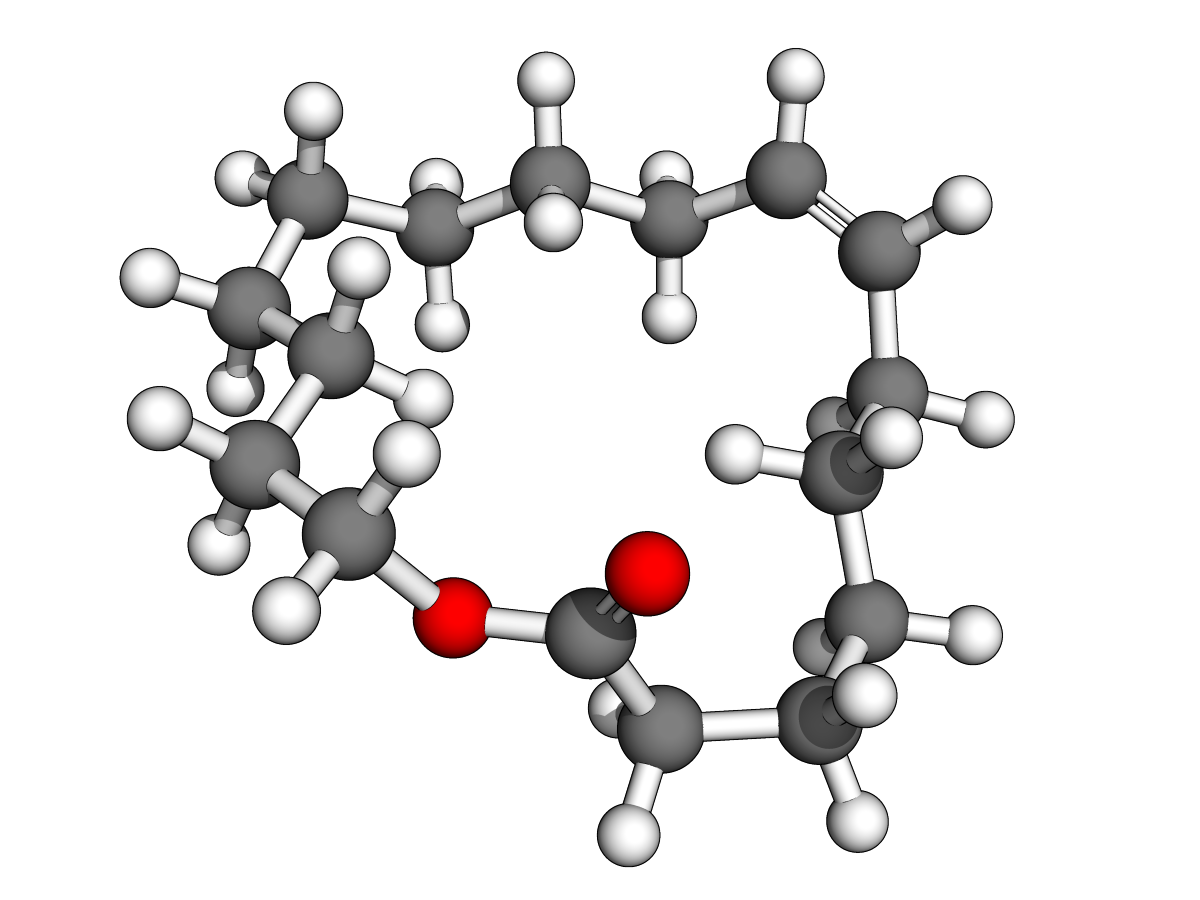
(E)-oxacycloheptadéc-10-èn-2-one