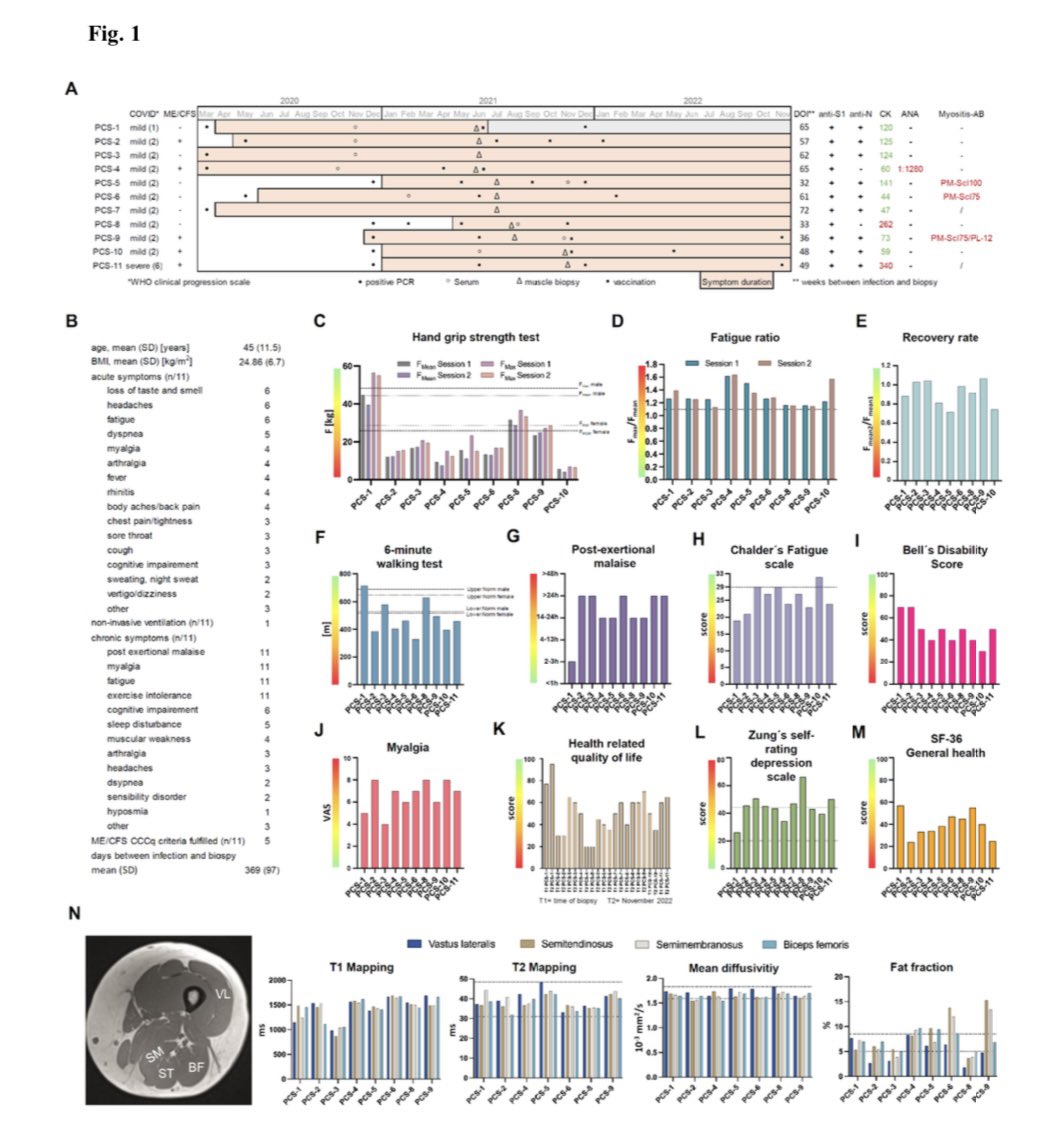
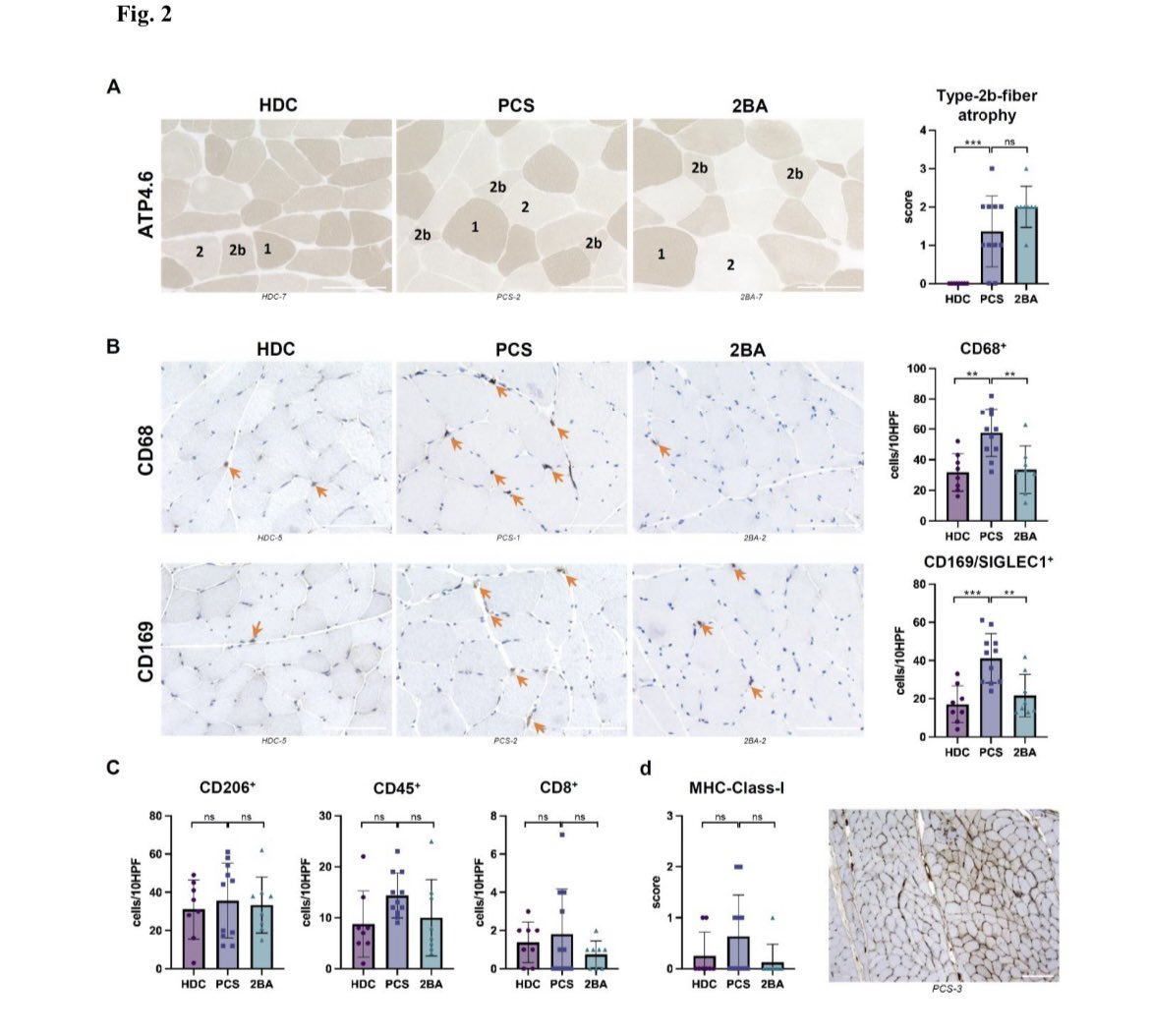
#SARSCoV2-Infektion des Thymus führt zu einem Funktionsverlust, der mit der Schwere der Erkrankung korreliert
Diese Studie präsentiert zum ersten Mal Beweise dafür, dass der Thymus ein Ziel der SARS-CoV-2-Infektion in vivo ist und dass die…
#COVID19 #LongCovid #Coronavirus
Diese Studie präsentiert zum ersten Mal Beweise dafür, dass der Thymus ein Ziel der SARS-CoV-2-Infektion in vivo ist und dass die…
#COVID19 #LongCovid #Coronavirus

Thymusfunktion bei Patienten mit #COVID19 beeinträchtigt ist.
Die Thymusdrüse ist das wichtigste Organ für die Bildung und Ausbildung von T-Zellen. Dieser Prozess hängt in hohem Maße vom Austausch zwischen den sich entwickelnden Thymozyten und dem thymischen Stromakompartiment
Die Thymusdrüse ist das wichtigste Organ für die Bildung und Ausbildung von T-Zellen. Dieser Prozess hängt in hohem Maße vom Austausch zwischen den sich entwickelnden Thymozyten und dem thymischen Stromakompartiment

ab, das aus thymischen Epithelzellen (TECs), Makrophagen, Endothelzellen, Fibroblasten und dendritischen Zellen besteht. Die TECs machen den größten Teil der thymischen Stromapopulation aus und ihren funktionellen Eigenschaften klassischerweise in kortikale und medulläre TECs
(cTECs bzw. mTECs) unterteilt.
In dieser Studie wird nachgewiesen, dass Patienten mit COVID-19 eine veränderte Thymusfunktion aufweisen und dass SARS-CoV-2 die Funktion des Thymusepithels direkt beeinflusst. Es konnte nachgewiesen werden, dass Patienten mit COVID-19 eine stark
In dieser Studie wird nachgewiesen, dass Patienten mit COVID-19 eine veränderte Thymusfunktion aufweisen und dass SARS-CoV-2 die Funktion des Thymusepithels direkt beeinflusst. Es konnte nachgewiesen werden, dass Patienten mit COVID-19 eine stark
reduzierte T-Zell-Produktion im Thymus aufweisen und dass der Schweregrad der Erkrankung mit einer Verschlechterung der Thymusfunktion verbunden ist. Das Angiotensin-konvertierende Enzym 2 (ACE2), der Hauptrezeptor für den Eintritt von SARS-CoV-2 in die Wirtszellen, wird im
Thymusepithel und insbesondere in mTECs exprimiert. Es wurde auch gezeigt, dass SARS-CoV-2 in TECs eindringen und deren Genexpressionsprofil beeinflussen kann, indem es Gene, die mit COVID-19 in Verbindung stehen, hochreguliert und Signalwege, die mit der Adhäsion 



und dem Überleben von Epithelzellen in Verbindung stehen, herunterreguliert.
Eine eingeschränkte Thymusfunktion bei Patienten mit COVID-19 könnte zu erheblichen immunologischen Konsequenzen führen. Die Thymusfunktion ist nicht nur von entscheidender Bedeutung für die

Eine eingeschränkte Thymusfunktion bei Patienten mit COVID-19 könnte zu erheblichen immunologischen Konsequenzen führen. Die Thymusfunktion ist nicht nur von entscheidender Bedeutung für die


Bildung des T-Zell-Pools im frühen Leben, sondern auch für die Wiederherstellung der T-Zell-Immunität nach immunologischen Beeinträchtigungen, wie sie beispielsweise durch antineoplastische Therapien, immunsuppressive Behandlungen und Infektionen verursacht werden. Eine 



verminderte Thymusfunktion und der daraus resultierende Rückgang des T-Zellen-Exports könnten die Lymphopenie bei akut erkrankten Patienten mit COVID-19 verschlimmern und die Zeit verlängern, die erforderlich ist, um die Anzahl und Funktion der zirkulierenden T-Zellen nach der
Genesung wiederherzustellen. Eine verzögerte Wiederherstellung der Thymusfunktion kann zur Entwicklung von Sekundärinfektionen beitragen, die den Schweregrad der Erkrankung verschlimmern, das Risiko eines Fortschreitens der Krankheit erhöhen und anhaltende Symptome im
Zusammenhang mit der Reaktivierung des Herpesvirus begünstigen können. Darüber hinaus könnten die direkten Auswirkungen von SARS-CoV-2 auf die TECs und die zusätzlichen Schäden, die durch den Anstieg proinflammatorischer Moleküle wie Interferone, IL-6 und TNF-α verursacht werden, 



die alle mit der akuten Thymusinvolution in Verbindung gebracht wurden, zu einer suboptimalen Ausbildung der sich entwickelnden Thymozyten führen. Ein gestörter Prozess der T-Zell-Entwicklung könnte den Prozess der zentralen Toleranz verändern und die Entwicklung von
T-Zell-Reaktionen auf Selbstantigene hervorrufen, die zur Entwicklung einer Autoimmunreaktion führen.
Die Studie belegt, dass SARS-CoV-2 direkt den Thymus angreifen und das Genexpressionsprofil des Thymusepithels verändern kann. Es Die Bewertung der
Die Studie belegt, dass SARS-CoV-2 direkt den Thymus angreifen und das Genexpressionsprofil des Thymusepithels verändern kann. Es Die Bewertung der
Thymusfunktionalität (z. B. durch die Quantifizierung von sjTRECs im peripheren Blut der Patienten) könnte ein nützlicher Marker sein, um Patienten mit COVID-19 zu identifizieren, die sowohl in der akuten als auch in der Genesungsphase ein Komplikationsrisiko haben. Obwohl die
Daten, die hier über die veränderte Expression potenzieller Autoantigene gesammelt wurden, begrenzt sind, lässt die Studie auch die Möglichkeit zu, dass die Störung der Thymusfunktion durch SARS-CoV-2 ein zusätzlicher Mechanismus sein könnte, der die übermäßige Entzündung
erklärt und möglicherweise zur Entwicklung von Autoimmunerkrankungen im Zusammenhang mit COVID-19 beiträgt.
sciencedirect.com/science/articl…
#COVID19 #ProtectTheKids #SARSCoV2 #Coronavirus #Covid_19 #LongCovid #LongCovidKids #ImpfenSchützt #MaskUp #CleanAir
sciencedirect.com/science/articl…
#COVID19 #ProtectTheKids #SARSCoV2 #Coronavirus #Covid_19 #LongCovid #LongCovidKids #ImpfenSchützt #MaskUp #CleanAir
• • •
Missing some Tweet in this thread? You can try to
force a refresh