Die #COVID19 #Impfstoffe haben aktuell eine bedingte #Zulassung in der EU.
Was ist das? Warum wurde das so gemacht? Gibts Auflagen für die Hersteller? Welche Arten der Zulassung gibts sonst noch? Und wann kommt die ‚normale‘ Zulassung?
Ein etwas längerer Thread…
1/n
Was ist das? Warum wurde das so gemacht? Gibts Auflagen für die Hersteller? Welche Arten der Zulassung gibts sonst noch? Und wann kommt die ‚normale‘ Zulassung?
Ein etwas längerer Thread…
1/n
1) Was ist eine bedingte Zulassung (conditional marketing authorization; CMA):
Die CMA wurde von der Europäischen Arzneimittelbehörde EMA 2006 ins Leben gerufen. Sie bietet einen regulatorischen Rahmen der es erlaubt Arzneimittel - unter bestimmten Bedingungen - schneller…
2/n
Die CMA wurde von der Europäischen Arzneimittelbehörde EMA 2006 ins Leben gerufen. Sie bietet einen regulatorischen Rahmen der es erlaubt Arzneimittel - unter bestimmten Bedingungen - schneller…
2/n
und mit weniger klinischen Daten zuzulassen. Dabei muss der Vorteil der schnelleren Verfügbarkeit gegenüber dem Nachteil, dass durch fehlende Daten ein Risiko entsteht, überwiegen. Also auch hier steht eine Risiko zu Nutzen Abwägung im Vordergrund.
In Betracht kommt die CMA…
3/n
In Betracht kommt die CMA…
3/n
für 2 Situationen:
-für neue lebensrettende Arzneimittel für die es bisher keine Alternativen gibt. In diese Gruppe fallen oft Arzneimittel gegen seltene Erkrankungen (orphan disease). Hier dauert die Rekrutierung von Patienten klinische Studien sehr lange.
4/n
-für neue lebensrettende Arzneimittel für die es bisher keine Alternativen gibt. In diese Gruppe fallen oft Arzneimittel gegen seltene Erkrankungen (orphan disease). Hier dauert die Rekrutierung von Patienten klinische Studien sehr lange.
4/n
-Notstand im Bereich der öffentlichen Gesundheit (zbsp Pandemie). Dieser Fall trifft für SARSCoV2/COVID19 zu.
EMA Seite zu CMA
ema.europa.eu/en/human-regul…
5/n
EMA Seite zu CMA
ema.europa.eu/en/human-regul…
5/n
Seit 2006 gibt es diesen Weg und 2017 hat die EMA ihre 10 Jahre Erfahrung in einem Bericht zusammengefasst.
Erwähnenswert, keines der 30 Arzneimittel welches vorzeitig durch eine CMA verfügbar wurde, musste später zurückgezogen werden, alle…
6/n
ema.europa.eu/en/documents/r…
Erwähnenswert, keines der 30 Arzneimittel welches vorzeitig durch eine CMA verfügbar wurde, musste später zurückgezogen werden, alle…
6/n
ema.europa.eu/en/documents/r…
erhielten im Durchschnitt nach 4 J die normale Zulassung. Seitdem sind einige dazugekommen.
In 2020 erhielten zbsp 13 Arzneimittel eine Empfehlung einer CMA ans CHMP:
Adakveo, Ayvakyt, Blenrep, Comirnaty, Enhertu, Hepcludex, Idefirix, Dovprela, Retsevmo, Rozlytrek…
7/n
In 2020 erhielten zbsp 13 Arzneimittel eine Empfehlung einer CMA ans CHMP:
Adakveo, Ayvakyt, Blenrep, Comirnaty, Enhertu, Hepcludex, Idefirix, Dovprela, Retsevmo, Rozlytrek…
7/n
Tecartus, Veklury and Zolgensma
Also man sieht, eine bedingte Zulassung ist nichts außergewöhnliches; und sie funktioniert.
ema.europa.eu/en/documents/a…
8/n
Also man sieht, eine bedingte Zulassung ist nichts außergewöhnliches; und sie funktioniert.
ema.europa.eu/en/documents/a…
8/n
2) Warum wurden das so gemacht?
Um schnelleren Zugang zu ermöglichen.
Der ‚normale‘ Weg benötigt Zeit; zum Einen sind die klinischen Studien zur Sicherheit und Wirksamkeit auf 3 Jahre angesetzt und zum Anderen benötigt ein vollständiger ‚normaler‘ Review eines…
9/n
Um schnelleren Zugang zu ermöglichen.
Der ‚normale‘ Weg benötigt Zeit; zum Einen sind die klinischen Studien zur Sicherheit und Wirksamkeit auf 3 Jahre angesetzt und zum Anderen benötigt ein vollständiger ‚normaler‘ Review eines…
9/n
Antrages (marketing authorization application) so ca 1 Jahr. Für einen Public Health Notfall natürlich nicht geeignet.
Und genau für diese Fall hat die EMA Abläufe im Rahmen einer CMA vorgesehen wie ‚rapid scientific advise‘ und ‚rolling review‘ die den Vorgang der…
10/n
Und genau für diese Fall hat die EMA Abläufe im Rahmen einer CMA vorgesehen wie ‚rapid scientific advise‘ und ‚rolling review‘ die den Vorgang der…
10/n
Begutachtung massiv beschleunigen.
ema.europa.eu/en/documents/l…
Zugelassen wurden die COVID19 Impfstoffe mit ~3-4 Monatsdaten zur Wirksamkeit und ~2 Monatsdaten zur Sicherheit
ema.europa.eu/en/documents/a…
11/n


ema.europa.eu/en/documents/l…
Zugelassen wurden die COVID19 Impfstoffe mit ~3-4 Monatsdaten zur Wirksamkeit und ~2 Monatsdaten zur Sicherheit
ema.europa.eu/en/documents/a…
11/n


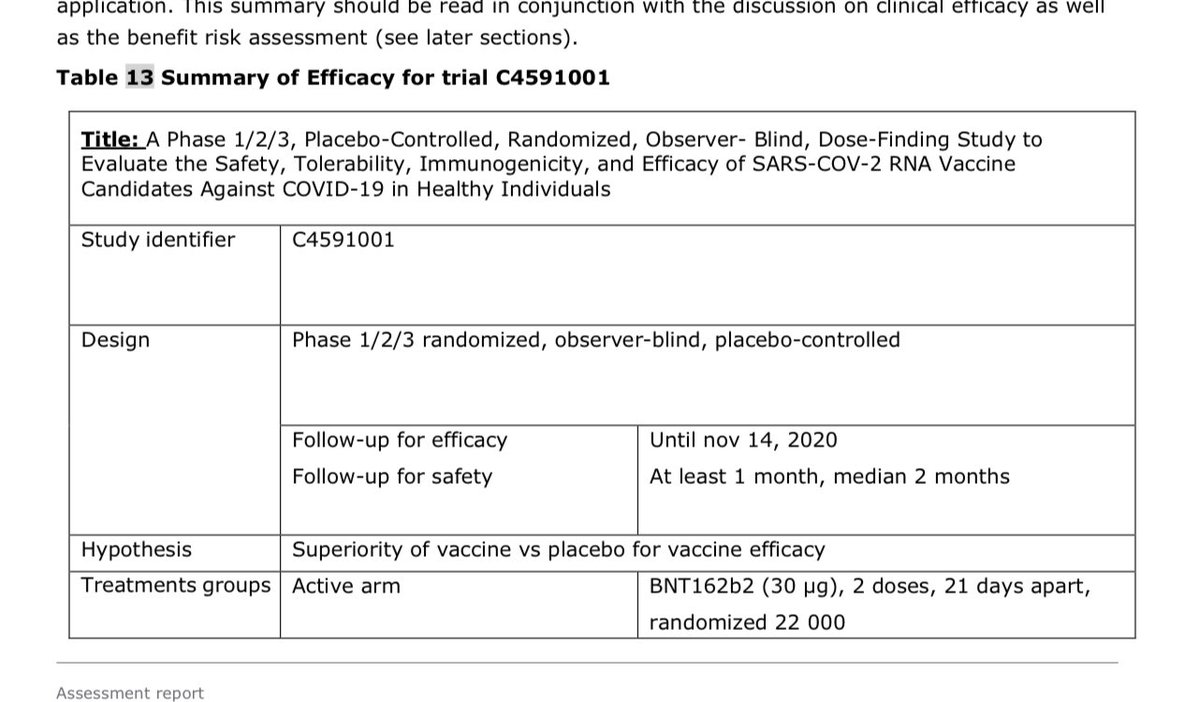
Aufgrund des hohen Infektionsgeschehens sah man eben schon sehr bald einen ausgeprägten Schutz vor symp Infektion. Inkl der Sicherheitsdaten war das Risiko zu Nutzen Verhältnis positiv. Die CMA wurde erteilt.
thelancet.com/journals/lance…
3) Auflagen an den Hersteller
Die CMA…
12/n
thelancet.com/journals/lance…
3) Auflagen an den Hersteller
Die CMA…
12/n
wird für 1 Jahr erteilt, dann
wird neu bewertet. Vor allem wird das Erfüllen der Auflagen geprüft. In erster Linie geht es natürlich darum mehr klinische Daten zu generieren und diese mit der Behörde zu teilen. Aber auch Auflagen bzw. der Kontrolle des Herstellprozesses und
13/n
wird neu bewertet. Vor allem wird das Erfüllen der Auflagen geprüft. In erster Linie geht es natürlich darum mehr klinische Daten zu generieren und diese mit der Behörde zu teilen. Aber auch Auflagen bzw. der Kontrolle des Herstellprozesses und
13/n

der Freigabe sind festgehalten.
Und wie bei jeder Zulassung muss ein Risikomanagement Programm definiert werden; dazu gehört zbsp das Sicherheitsmonitoring um frühzeitig seltene Nebenwirkungen detektieren zu können (Pharmakovigilanz).
ema.europa.eu/en/documents/r…
14/n
Und wie bei jeder Zulassung muss ein Risikomanagement Programm definiert werden; dazu gehört zbsp das Sicherheitsmonitoring um frühzeitig seltene Nebenwirkungen detektieren zu können (Pharmakovigilanz).
ema.europa.eu/en/documents/r…
14/n
4) Welche Arten der beschleunigten Zulassung gibts sonst noch?
Neben der CMA gibt es als zentralisiertes EU Verfahren noch
-Zulassung in Ausnahmefällen (under exceptional circumstances)
Wenn nicht zu erwarten ist, dass jemals Daten einer klinischen Studie vorliegen…
15/n
Neben der CMA gibt es als zentralisiertes EU Verfahren noch
-Zulassung in Ausnahmefällen (under exceptional circumstances)
Wenn nicht zu erwarten ist, dass jemals Daten einer klinischen Studie vorliegen…
15/n
werden; zbsp bei sehr seltenen Krankheiten. Bsp Aldurazyme (Laronidase) gegen Mukopolysaccharidose I.
-Beschleunigte Zulassung (accelerated assessment)
Kommt zum Einsatz bei Arzneimittel die eine echte Revolution bei der Behandlung eines Krankheitsbildes versprechen.
16/n
-Beschleunigte Zulassung (accelerated assessment)
Kommt zum Einsatz bei Arzneimittel die eine echte Revolution bei der Behandlung eines Krankheitsbildes versprechen.
16/n
Hier erfolgt einfach ein sehr rascher Review durch die Behörde.
5) Wann kommt die ‚normale‘ Zulassung?
In den USA möglicherweise schon nächstes Monat. In der EU schwer zu sagen. Möglicherweise mit dem Vorliegen der 1 Jahres Daten, möglicherweise aber auch erst später.
17/n
5) Wann kommt die ‚normale‘ Zulassung?
In den USA möglicherweise schon nächstes Monat. In der EU schwer zu sagen. Möglicherweise mit dem Vorliegen der 1 Jahres Daten, möglicherweise aber auch erst später.
17/n
• • •
Missing some Tweet in this thread? You can try to
force a refresh